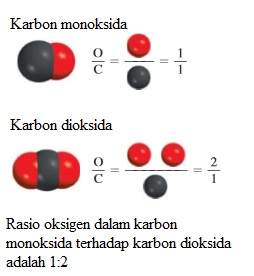
Berdasarkan teori atom Dalton, atom dapat didefinisikan sebagai satuan dasar dari suatu unsur yang dapat bergabung dalam kombinasi kimia. Dalton membayangkan atom kedua unsur yang bergabung sangat kecil dan tak dapat dibagi lagi. Namun, serangkaian penyelidikan yang dimulai pada tahun 1850-an dan diperluas pada abad ke-20 dengan jelas menunjukkan bahwa atom sebenarnya memiliki struktur internal; artinya, atom terdiri dari partikel yang lebih kecil, yang disebut partikel subatom. Penelitian ini mengarah pada penemuan tiga partikel yaitu: elektron, proton, dan neutron.
Atom terdiri dari proton, neutron dan elektron. Proton dan neutron berada di dalam inti atom, sedangkan elektron mengelilingi inti atom karena muatan listriknya. Semua elektron bermuatan negatif (-) dan semua proton bermuatan positif (+), sedangkan neutron tidak bermuatan atau netral. Elektron yang bermuatan negatif (-) ditarik oleh proton yang bermuatan positif (+) ke inti atom.
Dalam hal ini, semua inti atom di alam semesta akan ditemukan bermuatan positif (+) karena ada muatan listrik positif (+) di dalam inti. Akibatnya, semua inti atom akan saling bertolakan satu sama lain.
Elektron
Pada tahun 1890-an, banyak ilmuwan terperangkap dalam penelitian tentang radiasi, emisi dan transmisi energi melalui ruang dalam bentuk gelombang. Informasi yang diperoleh dari penelitian ini sangat berkontribusi pada pemahaman tentang struktur atom. Salah satu perangkat yang digunakan untuk menyelidiki fenomena ini adalah tabung sinar katoda, yang merupakan pelopor tabung televisi (Gambar 2.3). Tabung sinar katoda adalah tabung kaca dimana sebagian besar udara telah divakumkan. Ketika dua pelat logam terhubung ke sumber listrik tegangan tinggi, pelat bermuatan negatif disebut katoda memancarkan sinar tak terlihat. Sinar katoda ditarik ke pelat bermuatan positif yang disebut anoda di mana sinar melewati lubang dan terus bepergian ke ujung tabung. Ketika sinar menyambar permukaan yang dilapisi khusus, peristiwa itu menghasilkan fluoresensi yang kuat, atau cahaya terang.
Dalam beberapa percobaan, dua pelat bermuatan listrik dan magnet ditambahkan ke bagian luar tabung sinar katoda (lihat Gambar 2.3). Ketika medan magnet menyala dan medan listrik mati, sinar katoda menyerang titik A. Ketika medan listrik menyala, penangkapan sinar di titik C. Ketika medan magnet dan medan listrik mati atau ketika keduanya seimbang sehingga keduanya saling menghilangkan pengaruh satu sama lain, pengangkapan sinar di titik B. Menurut teori elektromagnetik, benda yang bermuatan bergerak berperilaku seperti magnet dan dapat berinteraksi dengan medan listrik serta magnet yang dilewatinya. Karena sinar katoda tertarik oleh pelat yang membawa muatan positif dan ditolak oleh pelat yang mengandung muatan negatif, maka harus terdiri dari partikel bermuatan negatif. Diketahui bahwa partikel bermuatan negatif ini adalah elektron. Gambar 2.4 menunjukkan efek dari magnet batang pada sinar katoda.
Seorang fisikawan Inggris bernama J. J. Thomson menggunakan tabung sinar katoda dan pengetahuannya tentang teori elektromagnetik untuk menentukan rasio muatan listrik terhadap massa elektron secara individu. Angka yang didapatkan adalah -1,759 x 10⁸ coulomb/gram, di mana C adalah singkatan dari coulomb, yang merupakan satuan muatan listrik. Setelah itu, dalam serangkaian percobaan yang dilakukan antara tahun 1908 dan 1917, R. A. Millikan berhasil mengukur muatan elektron dengan ketepatan yang tinggi. Karyanya membuktikan bahwa muatan pada setiap elektron sama persis. Dalam eksperimennya, Millikan memeriksa gerakan tetesan kecil minyak yang bermuatan listrik statis dari ion di udara. Dia menangguhkan tetesan minyak di udara dengan menerapkan medan listrik serta mengikuti gerakan Animasi mereka melalui mikroskop (Gambar 2.5). Menggunakan pengetahuannya tentang elektrostatik, Millikan menemukan muatan elektron adalah -1,6022 x 10⁻¹⁹ coulomb. Dari data ini ia menghitung massa elektron:
Massa satu elektron = e/(e/m) = (1,602 x 10⁻¹⁹) / (1,759 x 10⁸) = 9,11 × 10⁻²⁸ gram
Ini adalah massa yang sangat kecil sekali.
Ini adalah massa yang sangat kecil sekali.
Gambar 2.3 Sebuah tabung sinar katoda dengan medan listrik yang tegak lurus terhadap arah sinar katoda dan medan magnet eksternal. Simbol N dan S menunjukkan kutub magnet utara dan selatan. Sinar katoda akan menghantam ujung tabung di A di hadapan medan magnet, di C di hadapan medan listrik, dan di B ketika tidak ada medan eksternal yang hadir atau ketika efek medan listrik dan medan magnet saling menghilangkan.
Gambar 2.4 (a) Suatu sinar katoda yang dihasilkan dalam tabung vakum. Sinar itu sendiri tidak terlihat, tetapi fluoresensi lapisan seng sulfat pada kaca menyebabkannya tampak hijau. (b) Sinar katoda dibelokkan ke bawah ketika sebuah batang magnet dibawa ke arahnya. (c) Ketika polaritas magnet terbalik, sinar membelok ke arah yang berlawanan.
Radioaktivitas
Pada tahun 1895, fisikawan Jerman bernama Wilhelm Röntgen mengamati bahwa sinar katoda yang ditimbulkan kaca dan logam memancarkan sinar yang sangat tidak biasa. Radiasi yang sangat energik ini menembus materi, piring fotografi tertutup gelap, dan menyebabkan berbagai zat berfluoresensi. Karena sinar ini tidak dapat dibelokkan oleh magnet, maka tidak mengandung partikel bermuatan seperti sinar katoda. Röntgen menyebutnya dengan sinar X karena sifatnya tidak diketahui.
Gambar 2.5. Diagram skematis dari percobaan tetes minyak Millikan.
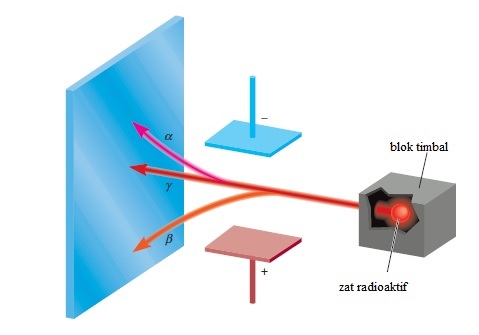
Gambar 2.6. Tiga jenis sinar yang dipancarkan oleh unsur radioaktif. sinar β terdiri dari partikel bermuatan negatif (elektron) dan karena itu tertarik oleh pelat bermuatan positif. Kebalikannya berlaku untuk sinar α bermuatan positif dan tertarik ke pelat bermuatan negatif. Karena sinar γ tidak memiliki muatan, jalurnya tidak terpengaruh oleh medan listrik eksternal.
Tidak lama setelah penemuan Röntgen, Antoine Becquerel seorang profesor fisika di Paris, mulai mempelajari sifat fluoresensi zat. Murni karena kebetulan, ia menemukan bahwa pelat fotografi yang dibungkus tebal terekspos oleh senyawa uranium yang menyebabkannya menjadi gelap, bahkan tanpa stimulasi sinar katoda. Seperti sinar X, sinar dari senyawa uranium sangat energik dan tidak dapat dibelokkan oleh medan magnet, tetapi sinarnya berbeda dari sinar X karena sinar ini muncul secara spontan. Salah satu siswa Becquerel bernama Marie Curie menyarankan nama radioaktivitas untuk menggambarkan emisi partikel dan/atau radiasi spontan ini. Sejak itu, setiap unsur yang secara spontan memancarkan radiasi disebut unsur radioaktif.
Tiga jenis sinar dihasilkan oleh peluruhan atau penghancuran zat radioaktif seperti uranium. Dua dari tiga yang dibelokkan oleh pelat logam yang bermuatan secara berlawanan (Gambar 2.6). Sinar alfa (α) terdiri dari partikel bermuatan positif, yang disebut partikel α, dan oleh karena itu terdefleksi (dibelokkan) oleh pelat bermuatan positif. Sinar beta (β), atau partikel β adalah elektron dan dibelokkan oleh pelat bermuatan negatif. Jenis ketiga dari radiasi radioaktif terdiri dari sinar berenergi tinggi yang disebut sinar gamma (γ). Seperti sinar X, sinar γ tidak memiliki muatan dan tidak terpengaruh oleh medan listrik eksternal.
Catatan kaki:
Antoine Henri Becquerel (1852–1908). Fisikawan Prancis yang dianugerahi Hadiah Nobel dalam bidang Fisika pada 1903 karena menemukan radioaktivitas dalam uranium. Marie (Marya Sklodowska) Curie (1867–1934). Kimiawan dan fisikawan kelahiran Polandia. Pada 1903 ia dan suaminya orang Prancis, Pierre Curie, dianugerahi Hadiah Nobel dalam Fisika untuk pekerjaan mereka dalam radioaktivitas. Pada tahun 1911, ia kembali menerima hadiah Nobel, kali ini dalam bidang kimia, untuk karyanya pada unsur radioaktif radium dan polonium. Dia adalah satu dari hanya tiga orang yang menerima dua hadiah Nobel dalam sains. Terlepas dari kontribusinya yang besar terhadap sains, pencalonannya untuk Akademi Ilmu Pengetahuan Perancis pada tahun 1911 ditolak oleh satu suara karena dia adalah seorang wanita! Putrinya Irene, dan menantu laki-lakinya Frederic Joliot-Curie, berbagi Penghargaan Nobel dalam Kimia pada tahun 1935.
Proton dan Inti
Pada awal 1900-an, dua sifat atom menjadi jelas: atom mengandung elektron, dan bersifat netral secara muatan. Untuk menjaga netralitas muatannya, atom harus mengandung muatan positif dan negatif dalam jumlah yang sama. Oleh karena itu, Thomson mengusulkan bahwa atom dapat dianggap sebagai lingkup materi positif yang seragam di mana elektron tertanam seperti kismis dalam kue (Gambar 2.7). Model "plum-pudding" adalah model yang diterima selama beberapa tahun.
Gambar 2.7 Model atom Thomson, kadang-kadang digambarkan sebagai model "plum-pudding", yaitu makanan penutup tradisional Inggris yang mengandung kismis. Elektron tertanam dalam bola bermuatan positif yang seragam.
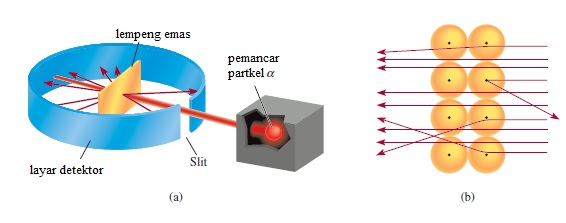
Gambar 2.8 (a) Rancangan percobaan Rutherford untuk mengukur hamburan partikel dengan selembar emas tipis (foil). Sebagian besar partikel melewati lembar (foil) emas dengan sedikit atau tanpa dibelokkan. Beberapa dibelokkan pada sudut lebar. Kadang-kadang sebuah partikel dipantul balik. (b) tampilan yang diperbesar dari partikel yang lewat dan dibelokkan oleh inti.
Pada tahun 1910 fisikawan Selandia Baru bernama Ernest Rutherford, yang pernah belajar dengan Thomson di Universitas Cambridge, memutuskan menggunakan partikel α untuk menyelidiki struktur atom. Bersama dengan rekannya Hans Geiger dan seorang sarjana bernama Ernest Marsden, Rutherford melakukan serangkaian percobaan menggunakan lembaran (foil) emas dan logam lain yang sangat tipis sebagai target partikel α dari sumber radioaktif (Gambar 2.8). Mereka mengamati bahwa sebagian besar partikel α menembus foil baik yang tidak terbelokkan atau hanya dengan sedikit belokkan. Tetapi setiap saat dan kemudian sebuah partikel α tersebar (atau dibelokkan) pada sudut yang besar. Dalam beberapa sampel, sebuah partikel α benar-benar dipantulkan kembali ke arah dari mana ia datang! Ini adalah temuan yang paling mengejutkan, karena dalam model Thomson muatan positif atom begitu menyebar sehingga partikel positif seharusnya melewati foil dengan sedikit belokkan (defleksi). Untuk mengutip reaksi awal Rutherford ketika diberitahu tentang penemuan ini: "Itu luar biasa seolah-olah Anda telah menembakkan cangkang 15 inci di selembar kertas tisu dan ia kembali dan menabrak Anda."
Rutherford kemudian mampu menjelaskan hasil eksperimen hamburan-α dalam hal model baru untuk atom. Menurut Rutherford, sebagian besar atom harus merupakan ruang kosong. Ini menjelaskan mengapa sebagian besar partikel melewati foil emas dengan sedikit atau tanpa belokkan. Muatan positif atom menurut usulan Rutherford semuanya terkonsentrasi di inti atom, yang merupakan inti padat di dalam pusat atom. Setiap kali sebuah partikel mendekati inti dalam eksperimen hamburan-α, partikel tersebut mengalami gaya tolak besar dan oleh karena itu dibelokkan dengan sudut besar. Selain itu, sebuah partikel α yang bergerak langsung menuju inti akan benar-benar ditolak dan arahnya akan berbalik.
Partikel bermuatan positif dalam inti disebut proton. Dalam percobaan terpisah, ditemukan bahwa setiap proton membawa muatan yang sama dengan elektron dan memiliki massa 1,6726231 × 10⁻²⁴ g — sekitar 1.840 kali massa elektron yang bermuatan negatif.
Pada tahap penyelidikan ini, para ilmuwan menganggap atom sebagai berikut: Massa inti merupakan sebagian besar massa seluruh atom, tetapi inti hanya menempati sekitar 1/1013 volume atom. Kita mengekspresikan dimensi atom (dan molekul) dalam satuan SI yang disebut picometer (pm), di mana
1 pm = 1 × 10⁻¹² m
Catatan kaki:
Ernest Rutherford (1871–1937). Fisikawan Selandia Baru. Rutherford melakukan sebagian besar pekerjaannya di Inggris (Universitas Manchester dan Cambridge). Dia menerima Hadiah Nobel dalam Kimia pada tahun 1908 untuk penyelidikannya dalam struktur inti atom. Komentarnya yang sering dikutip oleh murid-muridnya adalah bahwa “semua sains adalah fisika atau perangko.” Johannes Hans Wilhelm Geiger (1882–1945). Fisikawan Jerman. Pekerjaan Geiger terfokus pada struktur inti atom dan pada radioaktivitas. Dia menciptakan alat untuk mengukur radiasi yang sekarang biasa disebut penghitung Geiger. Ernest Marsden (1889–1970). Fisikawan Inggris. Sangat menggembirakan untuk mengetahui bahwa kadang-kadang seorang sarjana dapat membantu memenangkan Hadiah Nobel. Marsden melanjutkan untuk berkontribusi secara signifikan untuk pengembangan ilmu pengetahuan di Selandia Baru.
Jari-jari atom yang khas adalah sekitar 100 pm, sedangkan jari-jari inti atom hanya sekitar 5 × 10⁻³ pm. Kita dapat menghitung ukuran relatif atom dan intinya dengan membayangkan bahwa jika sebuah atom seukuran sebuah stadion olahraga, maka volume intinya akan sebanding dengan sebuah marmer kecil ditengah stadion. Meskipun proton terbatas pada inti atom, elektron dipahami tersebar di sekitar inti di beberapa jarak jauhnya darinya.
Stadion olahraga
Konsep jari-jari atom berguna secara eksperimental, tetapi kita tidak boleh menyimpulkan bahwa atom memiliki batas atau permukaan yang terdefinisi dengan baik. Kita akan belajar nanti bahwa daerah terluar atom relatif "kabur."
Neutron
Model struktur atom Rutherford meninggalkan satu masalah besar yang belum terpecahkan. Telah diketahui bahwa hidrogen merupakan atom paling sederhana, hanya mengandung satu proton dan bahwa atom helium mengandung dua proton. Oleh karena itu, perbandingan massa atom helium dengan atom hidrogen harus 2:1. (Karena elektron jauh lebih ringan daripada proton, kontribusinya terhadap massa atom dapat diabaikan.) Namun kenyataannya, rasio ini 4:1. Rutherford dan yang lain mempostulatkan bahwa harus ada jenis partikel subatom lainnya dalam inti atom; buktinya disediakan oleh fisikawan Inggris lainnya bernama James Chadwick, pada tahun 1932. Ketika Chadwick membombardir selembar berilium tipis dengan partikel, radiasi berenergi sangat tinggi mirip dengan sinar γ dipancarkan oleh logam. Percobaan selanjutnya menunjukkan bahwa sinar sebenarnya terdiri dari ketiga jenis partikel subatomik, yang Chadwick namai neutron, karena neutron terbukti sebagai partikel netral yang memiliki massa sedikit lebih besar daripada proton. Misteri rasio massa sekarang bisa dijelaskan. Dalam inti helium ada dua proton dan dua neutron, tetapi dalam inti hidrogen hanya ada satu proton dan tidak ada neutron; oleh karena itu, rasionya adalah 4:1.
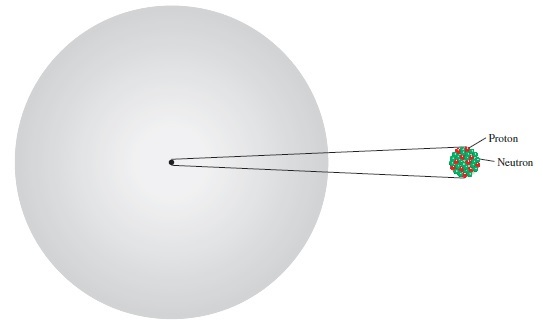
Gambar 2.9. Proton dan neutron atom dikemas dalam inti yang sangat kecil. Elektron ditampilkan sebagai "awan" di sekitar inti
Gambar 2.9 menunjukkan lokasi partikel dasar (proton, neutron, dan elektron) dalam sebuah atom. Ada partikel subatom lainnya, tetapi elektron, proton, dan neutron adalah tiga komponen fundamental dari atom yang penting dalam kimia. Tabel 2.1 menunjukkan massa dan muatan ketiga partikel dasar ini.
Tabel 2.1 Massa dan muatan partikel sub atom
Partikel
|
Massa (g)
|
Muatan
|
|
Coulomb
|
Satuan muatan
|
||
Elektron
|
9,10938 x 10-28
|
-1,6022 x 10-19
|
-1
|
Proton
|
1,67262 x 10-24
|
+1,6022 x 10-19
|
+1
|
Neutron
|
1,67493 x 10-24
|
0
|
0
|