Sejauh ini kita telah berkonsentrasi pada perilaku gas unsur murni atau senyawa murni saja, tetapi studi secara eksperimen sangat sering melibatkan bukan unsur atau senyawa murni saja melainkan campuran berbagai gas. Misalnya, untuk kajian polusi udara, kita mungkin tertarik pada hubungan tekanan-volume-suhu sampel udara, yang mengandung gas beberapa senyawa (misalnya CO₂, NO₂, SO₂). Dalam hal ini, dan semua kasus yang melibatkan campuran gas, tekanan gas total terkait dengan tekanan parsial, yaitu tekanan masing-masing komponen gas dalam campuran.
Pada tahun 1801, Dalton merumuskan hukum, yang sekarang dikenal sebagai hukum tekanan parsial Dalton, yang menyatakan bahwa tekanan total suatu campuran gas merupakan jumlah dari tekanan yang diberikan oleh masing-masing gas yang ada dalam campuran. Gambar 5.14 menggambarkan hukum Dalton.
Pada tahun 1801, Dalton merumuskan hukum, yang sekarang dikenal sebagai hukum tekanan parsial Dalton, yang menyatakan bahwa tekanan total suatu campuran gas merupakan jumlah dari tekanan yang diberikan oleh masing-masing gas yang ada dalam campuran. Gambar 5.14 menggambarkan hukum Dalton.
Gambar 5.14 Ilustrasi skematis hukum Dalton tentang tekanan parsial.
Perhatikan kasus di mana dua gas, A dan B, berada dalam wadah dengan volume V. Tekanan yang diberikan oleh gas A, menurut persamaan gas ideal, adalah
di mana nA adalah jumlah mol gas A. Demikian pula, tekanan yang diberikan oleh gas B adalah
Dalam campuran gas A dan B, tekanan total PT adalah hasil dari tabrakan kedua jenis molekul, A dan B, dengan dinding wadah. Jadi, menurut hukum Dalton,
di mana n, jumlah mol gas yang ada, diberikan oleh n = nA + nB, dan PA dan PB adalah tekanan parsial masing-masing gas A dan B. Untuk campuran gas, maka, PT hanya bergantung pada jumlah mol gas yang ada, bukan pada sifat molekul gas.
Secara umum, tekanan total campuran gas diberikan oleh
PT = P₁ + P₂ + P₃ + P₄ + ...
di mana P₁, P₂, P₃, P₄, . . . adalah tekanan parsial komponen 1, 2, 3, 4,. . . . Untuk mengetahui bagaimana setiap tekanan parsial terkait dengan tekanan total, pertimbangkan lagi kasus campuran dua gas A dan B. Dengan membagi PA dengan PT, didapatkan persamaan
di mana XA disebut fraksi mol A. Fraksi mol adalah kuantitas tak berdimensi yang menyatakan rasio jumlah mol satu komponen dibagi dengan jumlah mol semua komponen yang ada. Secara umum, fraksi mol komponen i dalam campuran diberikan oleh
di mana ni dan nT masing-masing adalah jumlah mol komponen i dan jumlah total mol komponen yang ada. Fraksi mol selalu lebih kecil dari 1. Sekarang dapat diyatakan tekanan parsial A sebagai
PA = XAPT
Hal yang juga sama untuk
PB = XBPT
Perhatikan bahwa jumlah fraksi mol untuk campuran gas harus sama dengan satu. Jika hanya ada dua komponen, maka
Jika suatu sistem mengandung lebih dari dua gas, maka tekanan parsial dari komponen ke-i terkait dengan tekanan total diberikan oleh
Pi = XiPT
Bagaimana tekanan parsial ditentukan? Manometer hanya dapat mengukur tekanan total dari campuran gas. Untuk mendapatkan tekanan parsial, perlu diketahui fraksi mol komponen, yang akan melibatkan analisis kimia yang rumit. Metode paling langsung untuk mengukur tekanan parsial adalah menggunakan spektrometer massa. Intensitas relatif dari puncak dalam spektrum massa berbanding lurus dengan jumlah mol, dan karenanya dapat berguna untuk mengetahui fraksi mol, dari gas yang ada.
Dari fraksi mol dan tekanan total, dapat dihitung tekanan parsial komponen individu, seperti yang ditunjukkan Contoh 5.14. Aplikasi langsung hukum Dalton tentang tekanan parsial untuk scuba diving dibahas dalam pengayaan 5.1.
Contoh 5.14
Campuran gas mengandung 4,46 mol neon (Ne), 0,74 mol argon (Ar), dan 2,15 mol xenon (Xe). Hitung tekanan parsial gas jika tekanan totalnya 2,00 atm pada suhu tertentu.
Strategi
Apa hubungan antara tekanan parsial gas dan tekanan total gas? Bagaimana menghitung fraksi mol gas?
Penyelesaian
Menurut Persamaan (5.14), tekanan parsial Ne (PNe) sama dengan hasilkali fraksi mol (XNe) dan tekanan total (PT)
PNe = XNePT
Menggunakan Persamaan (5.13), dapat dihitung fraksi mol Ne sebagai berikut:
sehingga,
Hal yang sama juga
dan
Periksa
Pastikan bahwa jumlah tekanan parsial sama dengan tekanan total yang diberikan; yaitu, (1,21 + 0,20 + 0,586) atm = 2,00 atm.
Latihan
Sampel gas alam mengandung 8,24 mol metana (CH₄), 0,421 mol etana (C₂H₆), dan 0,116 mol propana (C₃H₈). Jika tekanan total gas adalah 1,37 atm, berapa tekanan parsial gas?
Hukum tekanan parsial Dalton berguna untuk menghitung volume gas yang dikumpulkan di atas permukaan air. Misalnya, jika potasium klorat (KClO₃) dipanaskan, akan terurai menjadi KCl dan O₂:
2KClO₃(s) → 2KCl(s) + 3O₂(g)
Gas oksigen dapat dikumpulkan di atas permukaan air, seperti yang ditunjukkan pada Gambar 5.15. Awalnya, botol terbalik sepenuhnya diisi dengan air. Ketika gas oksigen dihasilkan, gelembung-gelembung gas naik ke atas dan memindahkan air dari botol. Metode pengumpulan gas ini didasarkan pada asumsi bahwa gas tersebut tidak bereaksi dengan air dan tidak mudah larut di dalamnya. Asumsi ini berlaku untuk gas oksigen, tetapi tidak untuk gas seperti NH₃, yang mudah larut dalam air. Gas oksigen yang dikumpulkan dengan cara ini tidak murni, karena uap air juga ada dalam botol. Total tekanan gas sama dengan jumlah tekanan yang diberikan oleh gas oksigen dan uap air:
Akibatnya, harus dibiarkan tekanan yang disebabkan oleh keberadaan uap air ketika menghitung jumlah O₂ yang dihasilkan. Tabel 5.3 menunjukkan tekanan uap air pada berbagai suhu. Data-data ini diplot pada Gambar 5.16.
Gambar 5.15 Peralatan untuk mengumpulkan gas di atas air. Oksigen yang dihasilkan oleh pemanasan kalium klorat (KClO₃) bersama sejumlah kecil mangan dioksida (MnO₂), yang mempercepat reaksi, digelembungkan melalui air dan dikumpulkan dalam botol seperti yang ditunjukkan. Air yang awalnya ada dalam botol didorong ke bak oleh gas oksigen.
Tabel 5.3 Tekanan Uap Air pada Berbagai Suhu
Gambar 5.16 Tekanan uap air sebagai fungsi suhu. Perhatikan bahwa pada titik didih air (100°C) tekanannya adalah 760 mmHg, yang persis sama dengan 1 atm.
Contoh 5.15
Gas oksigen yang dihasilkan dari penguraian kalium klorat dikumpulkan seperti yang ditunjukkan pada Gambar 5.15. Volume oksigen yang dikumpulkan pada 24°C dan tekanan atmosfer 762 mmHg adalah 128 mL. Hitung massa (dalam gram) gas oksigen yang diperoleh. Tekanan uap air pada 24°C adalah 22,4 mmHg.
Strategi
Untuk menyelesaikan massa O₂ yang dihasilkan, pertama-tama harus dihitung tekanan parsial O₂ dalam campuran. Hukum gas apa yang dibutuhkan? Bagaimana mengubah tekanan gas O₂ menjadi massa O₂ dalam gram?
Penyelesaian
Dari hukum Dalton tentang tekanan parsial, diketahui bahwa
PT = PO₂ + PH₂O
Sehingga
PO₂ = PT ₋ PH₂O
= 762 mmHg - 22,4 mmHg
= 740 mmHg
Dari persamaan gas ideal dapat dituliskan
di mana m dan ℳ masing-masing adalah massa O₂ yang dikumpulkan dan massa molar O₂. Dengan menyusun ulang persamaan didapatkan
Periksa
Kerapatan gas oksigen adalah (0,164 g/0,128 L), atau 1,28 g/L, yang merupakan nilai yang wajar untuk gas dalam keadaan atmosfer (lihat Contoh 5.8).
Latihan
Gas hidrogen dihasilkan ketika logam kalsium bereaksi dengan air dikumpulkan seperti yang ditunjukkan pada Gambar 5.15. Volume gas yang dikumpulkan pada 30°C dan tekanan 988 mmHg adalah 641 mL. Berapa massa (dalam gram) gas hidrogen yang diperoleh? Tekanan uap air pada 30°C adalah 31,82 mmHg.
Setiap bidang warna mewakili molekul gas yang berbeda. Hitung tekanan parsial gas jika tekanan totalnya adalah 2,6 atm.










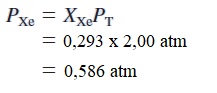



















No comments:
Post a Comment
Note: Only a member of this blog may post a comment.