SIFAT-SIFAT KEPERIODIKAN UNSUR
Sebelum belajar, kalian mengerjakan prites terlebih dahulu ya...
Materi Sifat-sifat Keperiodikan Unsur
Atom merupakan bagian terkecil dari unsur, sehingga dapat disimpulkan bahwa sifat suatu unsur ditentukan oleh keadaan dari atom-atom penyusun unsur tersebut. Atom tersusun dari inti atom (proton dan neutron) yang dikelilingi oleh elektron. Unsur-unsur dalam satu golongan mempunyai elektron valensi yang sama, sedangkan unsur-unsur dalam satu periode mempunyai elektron valensi yang menghuni kulit yang sama. Maka sifat-sifat unsur mempunyai hubungan dengan konfigurasi elektron, dimana unsur-unsur dengan konfigurasi elektron yang mirip akan mempunyai sifat yang mirip. Sifat-sifat yang terlihat dalam tabel periodik unsur yaitu:
1. Jari-jari Atom
- Dalam satu golongan semakin ke bawah, periode( jumlah kulit) bertambah, meskipun dalam hal ini jumlah muatan inti semakin banyak tetapi pengaruh bertambahnya jumlah kulit lebih besar daripada pengaruh muatan inti. Akibatnya jarak elektron kulit terluar terhadap inti makin jauh (panjang).
- Dalam satu periode semakin ke kanan, jumlah kulit elektronnya tetap tetapi muatan inti (nomor atom) dan jumlah elektron pada kulit semakin bertambah. Akibatnya, gaya tarik inti terhadap elektron terluar semakin kuat sehingga menyebabkan jarak elektron kulit terluar dengan inti semakin dekat (pendek).
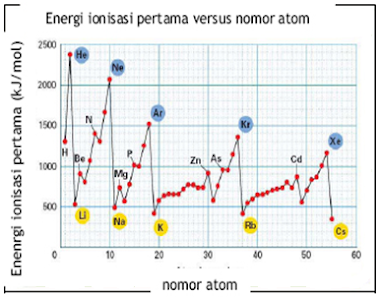
2. Energi Ionisasi
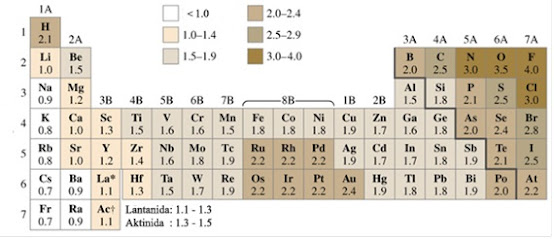
Dari tabel dan grafik tersebut terlihat bahwa:
- Dalam satu golongan semakin kebawah, jari-jari atom semakin besar (elektron valensinya semakin jauh dari inti), akibatnya elektron valensinya semakin mudah dilepas.
- Dalam satu periode dari kiri ke kanan cenderung mencapai kestabilan (mempunyai 8 elektron valensi). Golongan I,II, dan III cenderung melepaskan elektron sedangkan golongan V,VI, dan VII cenderung menerima elektron.
3. Afinitas Elektron
- Dalam satu golongan, muatan inti bertambah positif, jari-jari atom makin besar, dan gaya tarik inti terhadap elektron yang ditangkap makin lemah, akibatnya afinitas elektron berkurang.
- Dalam satu periode, muatan inti bertambah positif sedangkan jumlah kulit tetap menyebabkan gaya tarik inti terhadap elektron yang ditangkap makin kuat, akibatnya afinitas elektron cenderung bertambah.