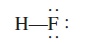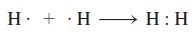Meskipun aturan oktet dan struktur Lewis tidak memberikan gambaran lengkap tentang ikatan kovalen, tetapi gambaran ini sangat membantu menjelaskan skema ikatan dalam banyak senyawa dan menjelaskan sifat dan reaksi molekul pada pokok bahasan bab berikutnya. Untuk alasan ini, kita harus berlatih cara menulis struktur Lewis senyawa. Langkah-langkah dasar cara menulis struktur Lewis adalah sebagai berikut:
- Tulis struktur rangka senyawa, menggunakan simbol-simbol kimia dan menempatkan atom-atom berdekatan satu sama lain. Untuk senyawa sederhana, tugas ini cukup mudah. Untuk senyawa yang lebih kompleks, kita harus diberi informasi atau membuat tebakan cerdas tentang hal itu. Secara umum, atom yang paling elektronegatif menempati posisi pusat. Hidrogen dan florin biasanya menempati posisi terminal (ujung) dalam struktur Lewis.
- Hitung jumlah total elektron valensi yang ada, merujuk, jika perlu, pada Gambar 9.1. Untuk anion poliatomik, tambahkan jumlah muatan negatif ke total elektron valensi itu. (Misalnya, untuk ion CO₃²⁻ kita menambahkan dua elektron karena muatan -2 menunjukkan bahwa ada dua elektron lebih banyak daripada yang disediakan oleh atom.) Untuk kation poliatomik, kita mengurangi jumlah muatan positif dari total jumlah ini. (Jadi, untuk NH₄⁺ kita kurangi satu elektron karena muatan +1 mengindikasikan lepasnya satu elektron dari kelompok atom.)
- Gambarlah ikatan kovalen tunggal antara atom pusat dan masing-masing atom di sekitarnya. Lengkapi oktet dari atom yang terikat pada atom pusat. (Ingat bahwa kulit valensi atom hidrogen lengkap hanya dengan dua elektron.) Elektron yang dimiliki atom pusat atau sekitarnya harus ditunjukkan sebagai pasangan elektron bebas jika pasangan elektronnya tidak terlibat dalam ikatan. Jumlah total elektron yang akan digunakan adalah yang ditentukan pada langkah 2.
- Setelah menyelesaikan langkah 1-3, jika atom pusat memiliki kurang dari delapan elektron, coba tambahkan ikatan rangkap atau rangkap tiga antara atom-atom di sekitarnya dan atom pusat, menggunakan pasangan elektron bebas dari atom-atom sekitarnya untuk melengkapi oktet dari atom pusat.
Contoh 9.3, 9.4, dan 9.5 mengilustrasikan prosedur empat langkah diatas untuk menulis struktur senyawa Lewis dan suatu ion.
Contoh 9.3
Tulis struktur Lewis untuk nitrogen trifluorida (NF₃) di mana ketiga atom F terikat pada atom N.
Penyelesaian
Kita mengikuti prosedur sebelumnya untuk menulis struktur Lewis.
Langkah 1: Atom N kurang elektronegatif daripada F, sehingga struktur kerangka NF₃ adalah
Langkah 2: Konfigurasi elektron terluar dari N dan F masing-masing adalah 2s²2p³ dan 2s²2p⁵. Dengan demikian, ada 5 + (3 x 7), atau 26, elektron valensi untuk diperhitungkan dalam NF₃.
Langkah 3: Kita menggambar ikatan kovalen tunggal antara N dan setiap F, dan menyelesaikan oktet untuk atom F. Kita menempatkan dua elektron yang tersisa pada N:
Karena struktur ini memenuhi aturan oktet untuk semua atom, langkah 4 tidak diperlukan.
Periksa
Hitung elektron valensi dalam NF₃ (dalam ikatan dan pasangan elektron bebas). Hasilnya adalah 26, sama dengan jumlah total elektron valensi pada tiga atom F (3 x 7 = 21) dan satu atom N (5).
Latihan
Tuliskan struktur Lewis untuk karbon disulfida (CS₂).
Tulis struktur Lewis untuk asam nitrat (HNO₃) di mana tiga atom O terikat pada atom pusat N dan atom H yang terionisasi terikat pada salah satu atom O.
Penyelesaian
Kita mengikuti prosedur yang sudah diuraikan untuk menulis struktur Lewis
Langkah 1: Struktur rangka HNO₃ adalah
Langkah 2: Konfigurasi elektron terluar N, O, dan H masing-masing adalah 2s²2p³, 2s²2p⁴, dan 1s¹. Dengan demikian, ada 5 + (3 x 6) + 1, atau 24, elektron valensi yang diperhitungkan dalam HNO₃.
Langkah 3: Kita menarik ikatan kovalen tunggal antara N dengan masing-masing dari tiga atom O dan antara satu atom O dengan atom H. Lalu kita akan mengisi elektron untuk mematuhi aturan oktet untuk atom O:
Langkah 4: Kita melihat bahwa struktur ini memenuhi aturan oktet untuk semua atom O tetapi tidak untuk atom N. Atom N hanya memiliki enam elektron. Oleh karena itu, kita memindahkan pasangan elektron bebas dari salah satu atom O ujung untuk membentuk ikatan lain dengan N. Sekarang aturan oktet juga terpenuhi untuk atom N:
Periksa
Pastikan bahwa semua atom (kecuali H) memenuhi aturan oktet. Hitung elektron valensi dalam HNO₃ (dalam ikatan dan pasangan elektron bebas). Hasilnya adalah 24, sama dengan jumlah total elektron valensi pada tiga atom O (3 x 6 = 18), satu atom N (5), dan satu atom H (1).
Latihan
Tulis struktur Lewis untuk asam formiat (HCOOH).
Contoh 9.5
Tulis struktur Lewis untuk ion karbonat (CO₃²⁻).
Penyelesaian
Kita mengikuti prosedur sebelumnya untuk menulis struktur Lewis dan mencatat bahwa ini adalah anion dengan dua muatan negatif.
Langkah 1: Kita dapat menyimpulkan struktur kerangka ion karbonat dengan mengakui bahwa C kurang elektronegatif daripada O. Oleh karena itu, hanya kemungkinan atom C menempati posisi pusat sebagai berikut:
Langkah 2: Konfigurasi elektron kulit terluar C dan O masing-masing adalah 2s²2p² dan 2s²2p⁴, dan ion itu sendiri memiliki dua muatan negatif. Dengan demikian, jumlah total elektron adalah 4 + (3 x 6) + 2, atau 24.
Langkah 3: Kita menarik ikatan kovalen tunggal antara C dengan masing-masing O dan mematuhi aturan oktet untuk atom O:
Struktur ini menunjukkan semua ada 24 elektron.
Langkah 4: Meskipun aturan oktet terpenuhi untuk atom O, tetapi tidak untuk atom C. Oleh karena itu, kita memindahkan pasangan elektron bebas dari salah satu atom O untuk membentuk ikatan lain dengan C. Sekarang aturan oktet juga terpenuhi untuk atom C:
Periksa
Pastikan bahwa semua atom memenuhi aturan oktet. Hitung elektron valensi dalam CO₃²⁻ (dalam ikatan kimia dan pasangan elektron bebas). Hasilnya adalah 24, sama dengan jumlah total elektron valensi pada tiga atom O (3 x 6 = 18), satu atom C (4), dan dua muatan negatif (2).
Latihan
Tuliskan struktur Lewis untuk ion nitrit (NO₂⁻).
Ulasan Konsep
Model molekul yang ditunjukkan di sini merepresentasi guanin, komponen molekul DNA. Hanya ikatan antar atom yang ditampilkan dalam model ini. Gambarkan struktur molekul Lewis yang lengkap, yang menunjukkan semua ikatan rangkap dan pasangan elektron bebas.
Atom hitam mewakili karbon; biru-nitrogen; merah-oksigen; dan abu-abu-hidrogen.