Meskipun konsep molekul telah dimulai pada abad ketujuh belas, baru pada awal abad kedua puluh ahli kimia mulai memahami bagaimana dan mengapa molekul terbentuk. Terobosan utama dan pertama adalah usulan Gilbert Lewis bahwa ikatan kimia melibatkan penggunaan bersama pasangan elektron oleh atom-atom. Dia menggambarkan pembentukan ikatan kimia dalam H₂ sebagai
Jenis pasangan elektron ini adalah contoh dari ikatan kovalen, yaitu ikatan yang terbentuk dari dua elektron yang dipakai bersama oleh kedua atom H. Senyawa kovalen adalah senyawa yang hanya mengandung ikatan kovalen. Untuk penyederhanaan, pasangan elektron yang dipakai bersama sering direpresentasikan oleh satu garis. Dengan demikian, ikatan kovalen dalam molekul hidrogen dapat ditulis sebagai H-H. Dalam ikatan kovalen, setiap elektron dalam pasangan yang dipakai bersama tertarik ke inti kedua atom. Daya tarik ini menyatukan kedua atom dalam H₂ dan daya tarik ini berperan dalam pembentukan ikatan kovalen pada molekul lain.
Ikatan kovalen diantara atom berelektron banyak hanya melibatkan elektron valensi. Perhatikan molekul florin (F₂). Konfigurasi elektron F adalah 1s²2s²2p⁵. Elektron 1s berenergi paling rendah dan tinggal di dekat inti sepanjang waktu. Karena alasan ini elektron dekat inti F tidak berpartisipasi dalam pembentukan ikatan. Jadi, setiap atom F memiliki tujuh elektron valensi (elektron 2s dan 2p). Menurut Gambar 9.1, hanya ada satu elektron tidak berpasangan pada F, sehingga pembentukan molekul F₂ dapat direpresentasikan sebagai berikut:
Perhatikan bahwa hanya dua elektron valensi yang berperan dalam pembentukan F₂, masing-masing satu elektron dari setiap atom. Yang lainnya, elektron yang tidak berpasangan, disebut pasangan elektron bebas (PEB) — pasangan elektron valensi yang tidak terlibat dalam pembentukan ikatan kovalen. Jadi, setiap F dalam F₂ memiliki tiga pasangan elektron bebas:
Struktur yang kita gunakan ini untuk mereprsentasikan senyawa kovalen, seperti H₂ dan F₂, disebut struktur Lewis. Struktur Lewis adalah representasi ikatan kovalen di mana pasangan elektron yang dipakai bersama ditampilkan sebagai garis atau sebagai pasangan titik-titik diantara kedua atom, dan pasangan elektron bebas ditampilkan sebagai pasangan titik pada masing-masing atom. Hanya elektron valensi yang diperlihatkan dalam struktur Lewis.
Mari kita perhatikan struktur Lewis molekul air. Gambar 9.1 menunjukkan simbol titik Lewis untuk oksigen dengan dua titik tidak berpasangan atau dua elektron tidak berpasangan, jadi kita harapkan bahwa O dapat membentuk dua ikatan kovalen. Karena hidrogen hanya memiliki satu elektron, hidrogen hanya dapat membentuk satu ikatan kovalen. Jadi, struktur Lewis untuk air adalah
Dalam hal ini, atom O memiliki dua pasangan elektron bebas. Atom hidrogen tidak memiliki pasangan elektron bebas karena hanya ada satu elektronnya dan digunakan untuk membentuk ikatan kovalen.
Dalam molekul F₂ dan H₂O, atom F dan O mencapai konfigurasi gas mulia dengan pemakaian bersama sepasang elektron:
Pembentukan molekul-molekul ini menggambarkan aturan oktet, yang diformulasikan oleh Lewis: Sebuah atom selain hidrogen cenderung membentuk ikatan sampai dikelilingi oleh delapan elektron valensi. Dengan kata lain, ikatan kovalen terbentuk ketika tidak ada cukup elektron untuk setiap atom individu memiliki oktet lengkap. Dengan pemakaian bersama pasangan elektron dalam ikatan kovalen, masing-masing atom dapat mencapai oktetnya. Pengecualian untuk hidrogen yang mencapai konfigurasi elektron gas mulia helium, cukup dengan dua elektron yang disebut duplet.
Aturan oktet dan duplet berfungsi terutama untuk unsur di periode kedua (Li dan Be duplet; B, C, O, N dan F oktet) dalam tabel periodik. Unsur-unsur ini hanya memiliki subkulit 2s dan 2p, yang dapat menampung total delapan elektron. Ketika sebuah atom dari salah satu unsur ini membentuk senyawa kovalen, atom ini dapat mencapai konfigurasi elektron gas mulia [Ne] dengan pemakaian bersama pasangan elektron dengan atom lain dalam senyawa yang sama. Kemudian, kita akan membahas sejumlah pengecualian penting terhadap aturan oktet yang memberi kita wawasan lebih lanjut tentang sifat ikatan kovalen.
Atom dapat membentuk berbagai jenis ikatan kovalen. Dalam satu ikatan, dua atom disatukan oleh satu pasangan elektron. Banyak senyawa disatukan oleh ikatan rangkap, yaitu ikatan yang terbentuk ketika dua atom memakai bersama dua atau lebih pasangan elektron. Jika dua atom memiliki dua pasangan elektron, ikatan kovalen disebut ikatan rangkap dua. Ikatan rangkap dua ditemukan dalam molekul karbon dioksida (CO₂) dan etilena (C₂H₄):
Ikatan rangkap tiga muncul ketika dua atom memakai bersama tiga pasang elektron, seperti pada molekul nitrogen (N₂):
Molekul asetilena (C₂H₂) juga mengandung ikatan rangkap tiga, ikatan ini antara dua atom karbon:
Perhatikan bahwa dalam senyawa etilena dan asetilena semua elektron valensi digunakan dalam pembentukan ikatan; tidak ada pasangan elektron bebas pada kedua atom karbon. Faktanya, dengan pengecualian karbon monoksida, molekul stabil yang mengandung karbon tidak memiliki pasangan elektron bebas pada atom karbon.
Panjang ikatan rangkap lebih pendek daripada ikatan kovalen tunggal. Panjang ikatan didefinisikan sebagai jarak antara inti kedua atom yang terikat secara kovalen dalam suatu molekul (Gambar 9.3). Tabel 9.2 menunjukkan beberapa panjang ikatan yang ditentukan secara eksperimen. Untuk pasangan atom tertentu, seperti karbon dan nitrogen, ikatan rangkap tiga lebih pendek dari ikatan rangkap dua, ikatan rangkap dua lebih pendek dari ikatan tunggal. Ikatan rangkap yang lebih pendek juga lebih stabil daripada ikatan tunggal, penjelasannya akan kita pelajari di bagian bab berikutnya.
Gambar 9.3 Panjang ikatan (dalam pm) dalam H₂ dan HI.
Tabel 9.2 Panjang Ikatan Rata-Rata untuk Beberapa Ikatan Tunggal, Rangkap Dua, dan Rangkap Tiga
Perbandingan Sifat-sifat Senyawa Kovalen dan Ionik
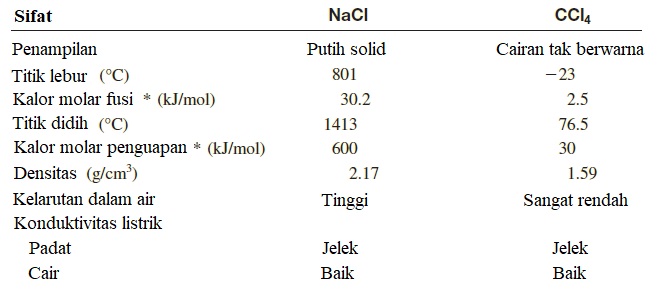
Senyawa ionik dan kovalen berbeda nyata dalam sifat fisika umumnya karena perbedaan sifat ikatan antara keduanya. Ada dua jenis kekuatan menarik dalam senyawa kovalen. Jenis pertama adalah gaya yang menyatukan atom-atom dalam sebuah molekul. Ukuran kuantitatif dari daya tarik ini diberikan oleh entalpi ikatan, yang dibahas dalam Bagian 9.10. Jenis kedua dari gaya tarik menarik yang beroperasi di antara molekul-molekul yang disebut gaya antar molekul. Karena gaya antarmolekul biasanya sangat lemah dibandingkan dengan gaya ikatan kovalen dalam suatu molekul, tetapi molekul-molekul senyawa kovalen tidak terikat bersama. Akibatnya senyawa kovalen biasanya berupa gas, cairan, atau padatan dengan titik leleh rendah. Di sisi lain, gaya elektrostatik yang mengikat ion bersama dalam senyawa ionik biasanya sangat kuat, sehingga senyawa ionik umumnya berbentuk padat pada suhu kamar dan memiliki titik leleh yang tinggi. Banyak dari senyawa ionik ini larut dalam air, dan larutan encer yang dihasilkan dapat menghantarkan arus listrik, karena senyawa ionik umumnya adalah elektrolit yang kuat. Sebagian besar senyawa kovalen tidak larut dalam air, atau jika larut, larutan encernya umumnya tidak menghantarkan listrik, karena senyawanya nonelektrolit. Larutan senyawa ionik menghantarkan listrik karena mengandung kation dan anion yang dapat bergerak; senyawa kovalen cair atau molten tidak menghantarkan listrik karena tidak ada ion. Tabel 9.3 membandingkan beberapa sifat umum senyawa ionik yang khas, natrium klorida (NaCl), dengan senyawa kovalen, karbon tetraklorida (CCl₄).
Tabel 9.3 Perbandingan Beberapa Sifat Umum dari Senyawa Ionik dan Senyawa kovalen
* Kalor molar fusi dan kalor molar penguapan adalah jumlah kalor yang dibutuhkan untuk melelehkan 1 mol padatan dan untuk menguapkan 1 mol cairan.






















No comments:
Post a Comment
Note: Only a member of this blog may post a comment.