Studi kuantitatif reaksi netralisasi asam-basa paling mudah dilakukan dengan menggunakan teknik yang dikenal sebagai titrasi. Dalam titrasi, konsentrasi larutan diketahui secara akurat, yang disebut larutan standar, ditambahkan secara bertahap ke larutan lain dengan konsentrasi yang tidak diketahui, sampai reaksi kimia antara kedua larutan selesai. Jika kita mengetahui volume larutan standar dan larutan yang tidak diketahui yang digunakan dalam titrasi, bersama dengan konsentrasi larutan standar, kita dapat menghitung konsentrasi larutan yang tidak diketahui tersebut.
Natrium hidroksida adalah salah satu pangkalan yang biasa digunakan di laboratorium. Namun, sulit untuk mendapatkan natrium hidroksida padat dalam bentuk murni karena memiliki kecenderungan untuk menyerap air dari udara, dan larutannya bereaksi dengan karbon dioksida. Untuk alasan ini, larutan natrium hidroksida harus distandarisasi sebelum dapat digunakan dalam pekerjaan analitik yang akurat. Kita dapat menstandarkan larutan natrium hidroksida dengan menditrasi larutan asam dengan konsentrasi yang diketahui secara akurat. Asam yang sering dipilih untuk tugas ini adalah asam monoprotik yang disebut kalium hidrogen ptalat (KHP), di mana rumus molekulnya adalah KHC₈H₄O₄ (massa molar = 204,2 g). KHP adalah padatan putih yang dapat larut yang tersedia secara komersial dalam bentuk sangat murni. Reaksi antara KHP dan natrium hidroksida adalah
KHC₈H₄O₄(aq) + NaOH(aq) → KNaC₈H₄O₄(aq) + H₂O(l)
dan persamaan ion bersihnya adalah
HC₈H₄O₄⁻(aq) + OH⁻(aq) → C₈H₄O₄²⁻(aq) + H₂O(l)
Prosedur untuk titrasi ditunjukkan pada Gambar 4.21. Pertama, jumlah KHP yang diketahui dipindahkan ke Erlenmeyer dan beberapa air suling ditambahkan untuk membuat larutan. Selanjutnya, larutan NaOH ditambahkan dengan hati-hati ke larutan KHP dari buret sampai kita mencapai titik ekivalen, yaitu titik di mana asam telah sepenuhnya bereaksi dengan atau dinetralkan oleh basa. Titik ekivalen biasanya ditandai oleh perubahan tajam dalam warna indikator dalam larutan asam. Dalam titrasi asam-basa, indikator adalah zat yang memiliki warna berbeda secara jelas dalam media asam dan basa. Salah satu indikator yang umum digunakan adalah fenolftalein, yang tidak berwarna dalam larutan asam dan netral tetapi merah muda kemerahan dalam larutan dasar. Pada titik ekivalen, semua KHP telah dinetralkan oleh NaOH yang ditambahkan dan larutan masih tidak berwarna. Namun, jika kita menambahkan hanya satu tetes lagi larutan NaOH dari buret, larutannya akan segera menjadi merah muda karena larutannya sekarang basa. Contoh 4.10 menggambarkan titrasi semacam itu.
Gambar 4.21 (a) Peralatan untuk titrasi asam-basa. Larutan NaOH ditambahkan dari buret ke larutan KHP dalam labu Erlenmeyer. (b) Warna merah muda kemerahan muncul ketika titik ekivalen tercapai. Warna di sini telah diintensifkan untuk tampilan visual.
Contoh 4.10
Dalam percobaan titrasi, seorang siswa menemukan bahwa 23,48 mL larutan NaOH diperlukan untuk menetralkan 0,5468 g KHP. Berapa konsentrasi (dalam molaritas) larutan NaOH?
Strategi
Kita ingin menentukan molaritas larutan NaOH. Apa definisi molaritas?
Volume larutan NaOH diberikan dalam soal. Oleh karena itu, kita perlu menemukan jumlah mol NaOH untuk dipecahkan untuk molaritas. Dari persamaan sebelumnya untuk reaksi antara KHP dan NaOH yang ditunjukkan dalam teks kita melihat bahwa 1 mol KHP menetralkan 1 mol NaOH. Berapa mol KHP yang terkandung dalam 0,5468 g KHP?
Penyelesaian
Pertama, kita menghitung jumlah mol KHP yang dikonsumsi dalam titrasi:
= 2,678 x 10⁻³ mol KHP
Karena 1 mol KHP ∞ 1 mol NaOH, harus ada 2,678 x 10⁻³ mol NaOH dalam 23,48 mL larutan NaOH. Akhirnya, kita menghitung jumlah mol NaOH dalam 1 L larutan atau molaritas sebagai berikut:
Latihan
Berapa gram KHP yang dibutuhkan untuk menetralkan 18,64 mL larutan 0,1004 M NaOH?
Reaksi netralisasi antara NaOH dan KHP adalah salah satu jenis netralisasi asam-basa paling sederhana yang diketahui. Namun, seandainya, alih-alih KHP, kita ingin menggunakan asam diprotik seperti H₂SO₄ untuk titrasi. Reaksi diwakili oleh
2NaOH(aq) + H₂SO₄(aq) → Na₂SO₄(aq) + 2H₂O(l)
Karena 2 mol NaOH ∞ 1 mol H₂SO₄, kita membutuhkan NaOH dua kali lebih banyak untuk bereaksi sepenuhnya dengan larutan H₂SO₄ dengan konsentrasi dan volume molar yang sama dengan asam monoprotik seperti HCl. Di sisi lain, kita akan membutuhkan dua kali jumlah HCl untuk menetralkan larutan Ba(OH)₂ dibandingkan dengan larutan NaOH yang memiliki konsentrasi dan volume yang sama karena 1 mol Ba(OH)₂ menghasilkan 2 mol ion OH⁻:
2HCl(aq) + Ba(OH)₂(aq) → BaCl₂(aq) + 2H₂O(l)
Dalam perhitungan yang melibatkan titrasi asam basa, terlepas dari asam atau basa yang terbentuk dalam reaksi, perlu diingat bahwa jumlah total mol ion H⁺ yang bereaksi pada titik ekivalen harus sama dengan jumlah total mol ion OH⁻ yang bereaksi.
Contoh 4.11 menunjukkan titrasi larutan NaOH dengan asam diprotik.
Contoh 4.11
Berapa mililiter (mL) larutan NaOH 0,610 M yang dibutuhkan untuk menetralkan 20,0 mL larutan 0,245 M H₂SO₄?
Strategi
Kita ingin menghitung volume larutan NaOH. Dari definisi molaritas [lihat Persamaan (4.1)], kita menulis
Dari persamaan untuk reaksi netralisasi yang baru saja ditunjukkan, kita melihat bahwa 1 mol H₂SO₄ menetralkan 2 mol NaOH. Berapa mol H₂SO₄ yang terkandung dalam 20,0 mL larutan 0,245 M H₂SO₄? Berapa mol NaOH yang akan dinetralkan oleh kuantitas H₂SO₄ ini?
Penyelesaian
Pertama-tama kita menghitung jumlah mol H₂SO₄ dalam larutan 20,0 mL:
Dari stoikiometri kita melihat bahwa 1 mol H₂SO₄ ∞ 2 mol NaOH. Oleh karena itu, jumlah mol NaOH yang direaksikan harus 2 x 4,90 x 10⁻³ mol, atau 9,80 x 10⁻³ mol. Dari definisi molaritas [lihat Persamaan (4.1)], kita miliki
atau
Latihan
Berapa mililiter larutan 1,28 M H₂SO₄ yang dibutuhkan untuk menetralkan 60,2 mL larutan 0,427 M KOH?
Ulasan Konsep
Larutan NaOH pada awalnya dicampur dengan larutan asam yang ditunjukkan pada (a). Manakah dari diagram yang ditunjukkan pada (b) - (d) sesuai dengan salah satu dari asam berikut: HCl, H₂SO₄, H₃PO₄? Kode warna: Bola biru (ion OH⁻); bola merah (molekul asam); bola hijau (anion dari asam). Asumsikan semua reaksi netralisasi asam-basa berjalan sempurna.



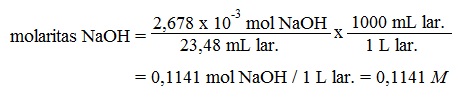


















No comments:
Post a Comment
Note: Only a member of this blog may post a comment.