Salah satu jenis reaksi yang umum terjadi pada larutan dalam air (zat yang dilarutkan dalam air) adalah reaksi presipitasi atau reaksi pengendapan, yang menghasilkan pembentukan produk yang tidak larut, atau endapan. Endapan adalah padatan tidak larut yang tidak bercampur dengan larutan. Reaksi presipitasi biasanya melibatkan senyawa ionik. Sebagai contoh, ketika larutan encer timbal (II) nitrat [Pb(NO₃)₂] ditambahkan ke dalam larutan kalium iodida (KI), terbentuk endapan timbal (II) iodida (PbI₂) berwarna kuning:
Pb(NO₃)₂(aq) + 2KI(aq) → PbI₂(s) + 2KNO₃(aq)
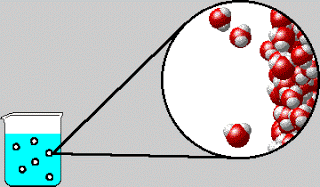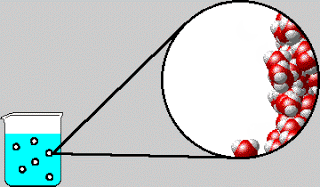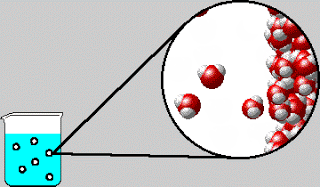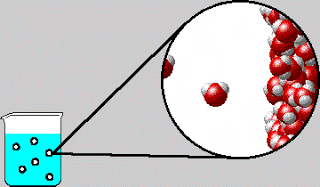
Kalium nitrat tetap di dalam larutan. Gambar 4.3 menunjukkan reaksi ini sedang berlangsung.
Reaksi di atas adalah contoh dari reaksi metatesis (juga disebut reaksi perpindahan ganda atau substitusi), reaksi yang melibatkan pertukaran komponen antara dua senyawa. (Dalam hal ini, kation dalam kedua senyawa saling berganti anion, sehingga Pb²⁺ berakhir dengan I⁻ sebagai PbI₂ dan K⁺ berakhir dengan NO₃⁻ sebagai KNO₃.) Seperti yang akan kita pelajari, reaksi presipitasi yang dibahas dalam bab ini adalah contoh reaksi metatesis.
Gambar 4.3 Pembentukan endapan PbI₂ kuning ketika larutan Pb(NO₃)₂ ditambahkan ke dalam larutan KI.
Kelarutan
Bagaimana kita dapat memprediksi apakah endapan akan terbentuk ketika suatu senyawa ditambahkan ke dalam larutan atau ketika dua larutan dicampur? Hal itu tergantung pada kelarutan zat terlarut, yang didefinisikan sebagai jumlah maksimum zat terlarut yang akan larut dalam jumlah tertentu pelarut pada suhu tertentu. Ahli kimia menyebutnya sebagai dapat larut, sedikit larut, atau tidak dapat larut dalam pengertian kualitatif. Suatu zat dikatakan dapat larut jika sejumlah besar zat larut ketika ditambahkan air. Jika tidak, zat tersebut dideskripsikan sebagai sedikit larut atau tidak dapat larut. Semua senyawa ionik adalah elektrolit yang kuat, tetapi tidak semuanya larut dalam air.
Tabel 4.2 mengelompokkan sejumlah senyawa ionik yang umum sebagai senyawa larut atau senyawa tidak larut. Perlu diingat, bahwa bahkan senyawa yang tidak larut pun larut sampai batas tertentu. Gambar 4.4 menunjukkan beberapa endapan.
Tabel 4.2 Aturan Kelarutan untuk Senyawa Ionik Umum dalam Air pada 25°C
Gambar 4.4. Penampilan beberapa endapan. Dari kiri ke kanan: CdS, PbS, Ni(OH)₂, dan Al(OH)₃.
Contoh 4.1 menerapkan aturan kelarutan dalam Tabel 4.2.
Contoh 4.1
Kelompokkan senyawa ionik berikut sebagai dapat larut atau tidak dapat larut: (a) perak sulfat (Ag₂SO₄), (b) kalsium karbonat (CaCO₃), (c) natrium fosfat (Na₃PO₄).
Strategi
Meskipun tidak perlu menghafal kelarutan senyawa, kita harus tetap mengingat aturan yang berguna berikut: semua senyawa ionik yang mengandung kation logam alkali; ion amonium; dan ion nitrat, bikarbonat, dan klorat adalah zat dapat larut. Untuk senyawa yang lain, kita perlu merujuk pada Tabel 4.2.
Penyelesaian
(a) Menurut Tabel 4.2, Ag₂SO₄ tidak dapat larut. (b) Ini adalah karbonat dan Ca adalah logam Golongan 2A. Oleh karena itu, CaCO₃ tidak dapat larut. (c) Natrium adalah logam alkali (Golongan 1A) jadi Na₃PO₄ larut.
Latihan
Kelompokkan senyawa ionik berikut sebagai dapat larut atau tidak dapat larut: (a) CuS, (b) Ca(OH)₂, (c) Zn(NO₃)₂.
Persamaan Molekul, Persamaan Ion, dan Persamaan Ion Bersih
Persamaan yang menggambarkan presipitasi timbal (II) iodida pada persamaan diatas disebut persamaan molekul karena rumus-rumus senyawa ditulis seolah-olah semua spesi ada sebagai molekul atau satuan utuh. Persamaan molekul berguna karena mengidentifikasi reagen [yaitu, timbal (II) nitrat dan kalium iodida]. Jika kita ingin membawa reaksi ini di laboratorium, kita akan menggunakan persamaan molekul. Namun, persamaan molekul tidak menjelaskan secara rinci apa yang sebenarnya terjadi dalam larutan.
Seperti yang ditunjukkan sebelumnya, ketika senyawa ionik larut dalam air, molekul dipecah menjadi kation dan anion komponennya. Agar lebih realistis, persamaan harus menunjukkan disosiasi senyawa ion terlarut menjadi anion dan kation. Oleh karena itu, kembali ke reaksi antara kalium iodida dan timbal II) nitrat, kita menulis
Pb²⁺(aq) + 2NO₃⁻(aq) + 2K⁺(aq) + 2I⁻(aq) → PbI₂(s) + 2K⁺(aq) + 2NO₃⁻(aq)
Persamaan ini adalah contoh persamaan ionik, yang menunjukkan spesi terlarut sebagai ion bebas. Untuk melihat apakah endapan terbentuk dari larutan ini, pertama-tama kita menggabungkan kation dan anion dari senyawa yang berbeda; yaitu, PbI₂ dan KNO₃. Mengacu pada Tabel 4.2, kita melihat bahwa PbI₂ adalah senyawa tidak dapat larut dan KNO₃ dapat larut. Oleh karena itu, KNO₃ terlarut tetap dalam larutan sebagai ion K⁺ dan NO₃⁻ yang terhidrasi, yang disebut ion penonton, atau ion yang tidak terlibat dalam reaksi keseluruhan. Karena ion penonton muncul di kedua sisi persamaan, ion-ion ini dapat dihilangkan dari persamaan ionik
Pb²⁺(aq) + 2NO₃⁻(aq) + 2K⁺(aq) + 2I⁻(aq) → PbI₂(s) + 2K⁺(aq) + 2NO₃⁻(aq)
Akhirnya, kita mendapatkan persamaan ion bersih, yang hanya menunjukkan spesi yang benar-benar terlibat dalam reaksi pengendapan:
Pb²⁺(aq) + 2I⁻(aq) → PbI₂(s)
Melihat contoh lain, kita menemukan bahwa ketika larutan barium klorida (BaCl₂) ditambahkan ke dalam larutan natrium sulfat (Na₂SO₄), terbentuk endapan putih (Gambar 4.5). Memperlakukan ini sebagai reaksi metatesis, produknya adalah BaSO₄ dan NaCl. Dari Tabel 4.2 kita melihat bahwa hanya BaSO₄ yang tidak larut. Oleh karena itu, kita menulis persamaan molekul sebagai berikut
BaCl₂(aq) + Na₂SO₄(aq) → BaSO₄(s) + 2NaCl(aq)
Persamaan ion untuk reaksi adalah
Ba²⁺(aq) + 2Cl⁻(aq) + 2Na⁺(aq) + SO₄²⁻ (aq) → BaSO₄(s) + 2Na⁺(aq) + 2Cl⁻(aq)
Menghilangkan ion penonton (Na⁺ dan Cl⁻) di kedua sisi persamaan memberi kita persamaan ion bersih
Ba²⁺(aq) + SO₄²⁻ (aq) → BaSO₄(s)
Gambar 4.5 Pembentukan endapan BaSO₄.
Empat langkah berikut merangkum prosedur untuk menulis persamaan ion dan persamaan ion bersih:
- Tulis persamaan molekul yang setara untuk reaksi, menggunakan rumus yang benar untuk senyawa reaktan dan produk ionik. Lihat Tabel 4.2 untuk memutuskan produk mana yang tidak larut dan karena itu akan muncul sebagai endapan.
- Tulis persamaan ion untuk reaksi. Senyawa yang tidak muncul sebagai endapan harus ditampilkan sebagai ion bebas.
- Identifikasi dan hilangkan ion penonton di kedua sisi persamaan. Tuliskan persamaan ion bersih untuk reaksi.
- Periksa apakah muatan dan jumlah atom setara dalam persamaan ion bersih.
Langkah-langkah ini diterapkan dalam Contoh 4.2.
Contoh 4.2
Prediksikan apakah yang terjadi ketika larutan kalium fosfat (K₃PO₄) dicampur dengan larutan kalsium nitrat [Ca(NO₃)₂]. Tuliskan persamaan ion bersih untuk reaksi ini!
Strategi
Dari informasi yang diberikan, pertama-tama berguna untuk menulis persamaan tidak setara
K₃PO₄(aq) + Ca(NO₃)₂(aq) → ?
Apa yang terjadi ketika senyawa ionik larut dalam air? Ion apa yang terbentuk dari pemisahan K₃PO₄ dan Ca(NO₃)₂? Apa yang terjadi ketika kation bertemu anion dalam larutan?
Penyelesaian
Dalam larutan, K₃PO₄ terdisosiasi menjadi ion K⁺ dan PO₄³⁻ dan Ca(NO₃)₂ terdisosiasi menjadi ion Ca²⁺ dan NO₃⁻. Menurut Tabel 4.2, ion kalsium (Ca²⁺) dan ion fosfat (PO₄³⁻) akan membentuk senyawa yang tidak dapat larut, kalsium fosfat [Ca₃(PO₄)₂], sedangkan produk lainnya, KNO₃ dapat larut dan tetap dalam larutan sebagai ion. Karena itu, ini adalah reaksi presipitasi. Kita mengikuti prosedur bertahap yang baru saja dijelaskan.
Langkah 1: Persamaan molekul setara untuk reaksi ini adalah
2K₃PO₄(aq) + 3Ca(NO₃)₂(aq) → Ca₃(PO₄)₂(s) + 6KNO₃(aq)
Langkah 2: Untuk menulis persamaan ion, senyawa yang larut ditampilkan sebagai ion terdisosiasi:
6K⁺(aq) + 2PO₄³⁻ (aq) + 3Ca²⁺(aq) + 6NO₃⁻(aq) → 6K⁺(aq) + 6NO₃⁻(aq) + Ca₃(PO₄)₂(s)
Langkah 3: Menghilangkan ion penonton (K⁺ dan NO₃⁻) di setiap sisi persamaan, kita mendapatkan persamaan ion bersih:
3Ca²⁺(aq) + 2PO₄³⁻ (aq) → Ca₃(PO₄)₂(s)
Langkah 4: Perhatikan bahwa karena kita pertama-tama menyetarakan persamaan molekul, persamaan ion bersih disetarakan dengan jumlah atom di setiap sisi dan jumlah muatan positif (+6) dan negatif (-6) di sisi kiri adalah sama.
Latihan
Prediksikan apakah endapan akan dihasilkan dengan mencampurkan larutan Al(NO₃)₃ dengan larutan NaOH. Tuliskan persamaan ion bersih untuk reaksi ini!
Ulasan Konsep
Manakah dari gambar berikut yang secara akurat menggambarkan reaksi antara Ca(NO₃)₂(aq) dan Na₂CO₃(aq)? Untuk penyederhanaan, hanya ion Ca²⁺(kuning) dan CO₃²⁻ (biru) yang ditampilkan.