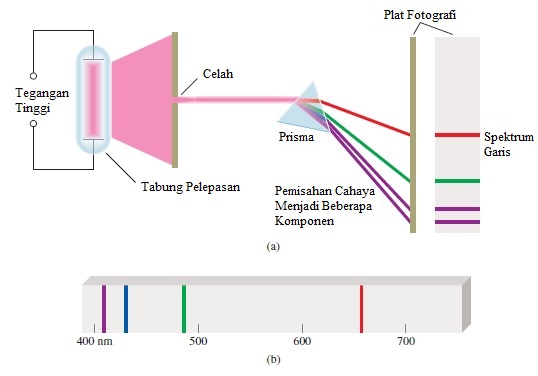
Keberhasilan spektakuler teori Bohr diikuti oleh serangkaian kekecewaan. Pendekatan Bohr tidak memperhitungkan spektrum emisi atom yang mengandung lebih dari satu elektron, seperti atom helium dan lithium. Juga tidak menjelaskan mengapa garis tambahan muncul dalam spektrum emisi hidrogen ketika medan magnet diterapkan. Masalah lain muncul dengan penemuan bahwa elektron itu mirip gelombang: Bagaimana "posisi" gelombang ditentukan? Kita tidak dapat menentukan lokasi gelombang yang tepat karena gelombang memanjang di angkasa.
Untuk menggambarkan masalah mencoba menemukan partikel subatomik yang berperilaku seperti gelombang, Werner Heisenberg merumuskan apa yang sekarang dikenal sebagai prinsip ketidakpastian Heisenberg: tidak mungkin untuk mengetahui secara bersamaan kedua momentum p (didefinisikan sebagai massa kali kecepatan) dan posisi suatu partikel dengan pasti. Dinyatakan secara matematis,
di mana 𝛥x dan 𝛥p adalah ketidakpastian dalam mengukur posisi dan momentum partikel, masing-masing. Tanda ≥ memiliki arti sebagai berikut. Jika ketidakpastian posisi dan momentum yang diukur adalah besar (katakanlah, dalam eksperimen kasar), produknya dapat secara substansial lebih besar daripada h/4𝝅 (karenanya tanda >). Signifikansi dari Persamaan 7.9 adalah bahwa bahkan dalam kondisi yang paling menguntungkan untuk mengukur posisi dan momentum, produk dari ketidakpastian tidak pernah dapat kurang dari h/4𝝅 (karenanya tanda =). Dengan demikian, membuat pengukuran momentum suatu partikel lebih tepat (yaitu, membuat 𝛥p dalam jumlah kecil) berarti bahwa posisi tersebut harus menjadi kurang tepat (yaitu, 𝛥x akan menjadi lebih besar). Demikian pula, jika posisi partikel diketahui lebih tepat, pengukuran momentumnya harus menjadi kurang tepat.
Menerapkan prinsip ketidakpastian Heisenberg pada atom hidrogen, kita melihat bahwa pada kenyataannya elektron tidak mengorbit inti dalam jalur yang didefinisikan dengan baik, seperti yang dipikirkan Bohr. Jika ya, kita dapat menentukan secara tepat posisi elektron (dari lokasinya pada orbit tertentu) dan momentumnya (dari energi kinetiknya) pada saat yang sama, sebuah pelanggaran terhadap prinsip ketidakpastian.
Yang pasti, Bohr memberikan kontribusi yang signifikan bagi pemahaman kita tentang atom, dan sarannya bahwa energi elektron dalam atom dikuantisasi tetap tidak tertandingi. Namun teorinya tidak memberikan deskripsi lengkap tentang perilaku elektronik dalam atom. Pada tahun 1926, fisikawan Austria Erwin Schrödinger, menggunakan teknik matematika yang rumit, merumuskan persamaan yang menggambarkan perilaku dan energi partikel submikroskopik secara umum, sebuah persamaan yang analog dengan hukum gerak Newton untuk objek makroskopik. Persamaan Schrödinger membutuhkan kalkulus canggih untuk diselesaikan, dan kita tidak akan membahasnya di sini. Penting untuk mengetahui, bagaimanapun, bahwa persamaan tersebut menggabungkan perilaku partikel, dalam hal massa m, dan perilaku gelombang, dalam hal fungsi gelombang 𝜓 (psi), yang tergantung pada lokasi dalam ruang sistem (seperti sebuah elektron dalam atom).
Fungsi gelombang itu sendiri tidak memiliki makna fisik langsung. Namun, probabilitas menemukan elektron di wilayah tertentu dalam ruang sebanding dengan kuadrat fungsi gelombang, 𝜓². Gagasan mengaitkan 𝜓² dengan probabilitas berasal dari analogi teori gelombang. Menurut teori gelombang, intensitas cahaya sebanding dengan kuadrat amplitudo gelombang, atau 𝜓². Tempat yang paling mungkin untuk menemukan foton adalah di mana intensitas terbesar, yaitu, di mana nilai 𝜓² terbesar. Argumen serupa mengaitkan 𝜓² dengan kemungkinan menemukan elektron di daerah sekitar inti.
Persamaan Schrödinger memulai era baru dalam fisika dan kimia, karena ia meluncurkan bidang baru, mekanika kuantum (juga disebut mekanika gelombang). Kita sekarang merujuk pada perkembangan dalam teori kuantum dari tahun 1913 — saat Bohr mempresentasikan analisisnya untuk atom hidrogen — sampai tahun 1926 sebagai “teori kuantum lama.”
Deskripsi Mekanika Kuantum dari Atom Hidrogen
Persamaan Schrödinger menentukan keadaan energi yang mungkin dimiliki elektron dalam atom hidrogen dan mengidentifikasi fungsi gelombang yang sesuai (𝜓). Keadaan energi dan fungsi gelombang ini ditandai oleh sejumlah bilangan kuantum (yang akan dibahas segera), yang dengannya kita dapat membuat model atom hidrogen yang komprehensif.
Meskipun mekanika kuantum memberi tahu kita bahwa kita tidak dapat menunjukkan dengan tepat elektron dalam atom, ia menentukan wilayah di mana elektron berada pada waktu tertentu. Konsep kerapatan elektron memberikan probabilitas bahwa elektron akan ditemukan di wilayah tertentu dari atom. Kuadrat dari fungsi gelombang, 𝜓², mendefinisikan distribusi kerapatan elektron dalam ruang tiga dimensi di sekitar inti. Daerah dengan kerapatan elektron yang tinggi menunjukkan probabilitas yang tinggi untuk menemukan elektron, sedangkan yang sebaliknya berlaku untuk daerah dengan kerapatan elektron yang rendah (Gambar 7.15).
Gambar 7.15 Representasi distribusi kerapatan elektron yang mengelilingi inti atom hidrogen. Ini menunjukkan probabilitas tinggi untuk menemukan elektron lebih dekat ke inti.
Untuk membedakan deskripsi mekanika kuantum dari atom dari model Bohr, kita berbicara tentang orbital atom, bukan orbit. Orbital atom dapat dianggap sebagai fungsi gelombang elektron dalam atom. Ketika kita mengatakan bahwa sebuah elektron berada dalam orbital tertentu, kita berarti bahwa distribusi kerapatan elektron atau probabilitas penempatan elektron dalam ruang dijelaskan oleh kuadrat fungsi gelombang yang terkait dengan orbital itu. Orbital atom, oleh karena itu, memiliki karakteristik energi, serta distribusi karakteristik kerapatan elektron.
Persamaan Schrödinger bekerja dengan baik untuk atom hidrogen sederhana dengan satu proton dan satu elektronnya, tetapi ternyata tidak dapat diselesaikan dengan tepat untuk setiap atom yang mengandung lebih dari satu elektron! Untungnya, ahli kimia dan fisikawan telah belajar untuk mengatasi kesulitan semacam ini dengan pendekatan. Sebagai contoh, meskipun perilaku elektron dalam atom banyak elektron (yaitu, atom yang mengandung dua atau lebih elektron) tidak sama dengan dalam atom hidrogen, kita menganggap bahwa perbedaannya mungkin tidak terlalu besar. Dengan demikian, kita dapat menggunakan energi dan fungsi gelombang yang diperoleh dari atom hidrogen sebagai perkiraan perilaku elektron dalam atom yang lebih kompleks. Faktanya, pendekatan ini memberikan deskripsi perilaku elektronik dalam atom banyak elektron yang cukup andal.