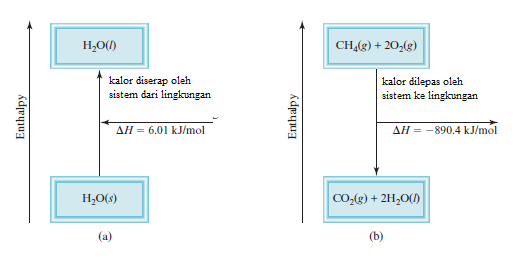
Di laboratorium, kalor pada proses perubahan fisika dan perubahan kimia diukur dengan kalorimeter, wadah tertutup yang dirancang khusus untuk tujuan tersebut. Diskusi tentang kalorimetri yaitu pengukuran perubahan kalor akan tergantung pada pemahaman tentang kalor jenis dan kapasitas kalor, jadi perlu diperhatikan terlebih dahulu.
Kalor Jenis dan Kapasitas Kalor
Kalor jenis atau kalor spesifik (c) suatu zat adalah jumlah kalor yang dibutuhkan untuk menaikkan suhu satu gram zat sebesar satu derajat Celcius. Kalor jenis memiliki satuan J/g°C. Kapasitas kalor (C) suatu zat adalah jumlah kalor yang dibutuhkan untuk menaikkan suhu kuantitas tertentu zat sebesar satu derajat Celcius. Satuannya adalah J/°C. Kalor jenis adalah sifat intensif sedangkan kapasitas kalor adalah sifat ekstensif (ingat sifat fisika dan sifat kimia zat). Hubungan antara kapasitas kalor dan kalor jenis suatu zat;
C = m . c (6.11)
di mana m adalah massa zat dalam gram. Misalnya, kalor jenis air adalah 4,184 J/g°C, dan kapasitas kalor dari 60,0 g air adalah
(60,0g)(4,184 J/g°C) = 251 J/°C
Tabel 6.2 menunjukkan kalor jenis dari beberapa zat yang umum dijumpai.
Jika kalor jenis dan jumlah zat diketahui, maka perubahan suhu (Δt) dalam sampel akan memberikan informasi jumlah kalor (q) yang telah diserap atau dilepaskan dalam proses tertentu. Persamaan untuk menghitung perubahan kalor diberikan oleh
q = m.c.Δt (persamaan 12)
q = C.Δt (persamaan 13)
dimana Δt adalah perubahan suhu:
Δt = takhir - tawal
Tanda konvensi untuk q adalah sama dengan tanda untuk perubahan entalpi; q positif untuk proses endotermis dan negatif untuk proses eksotermis.
Contoh 6.5
Sebuah sampel 466 g air dipanaskan dari 8,50°C menjadi 74,60°C. Hitung jumlah kalor yang diserap (dalam kilojoule) oleh air.
Strategi
Diketahui kuantitas air dan kalor jenis air. Dengan informasi ini dan kenaikan suhu, dapat dihitung jumlah kalor yang diserap (q).
Penyelesaian
q = m.c.Δt
= (466 g) (4,184 J/g°C) (74,60°C - 8,50°C)
= +1,29 x 105J
= +129 kJ
Periksa
Satuan g dan °C saling membatalkan, dan didapatkan satuan yang diinginkan kJ. Karena kalor diserap oleh air dari lingkungan, sehingga memiliki tanda positif.
Kalorimetri Volume Tetap
Kalor pembakaran biasanya diukur dengan menempatkan sejumlah senyawa yang diketahui massanya dalam wadah baja yang disebut "kalorimeter bom volume tetap", yang diisi dengan oksigen pada tekanan sekitar 30 atm. Bom tertutup direndam dalam air dengan kuantitas yang diketahui, seperti yang ditunjukkan pada Gambar 6.8. Sampel dinyalakan dengan listrik, dan kalor yang dihasilkan oleh reaksi pembakaran dapat dihitung secara akurat dengan mencatat kenaikan suhu air. Kalor yang dilepaskan oleh sampel diserap oleh air dan bom. Desain khusus dari kalorimeter memungkinkan untuk berasumsi bahwa tidak ada kalor (atau massa) yang hilang ke lingkungan selama waktu yang dibutuhkan untuk melakukan pengukuran. Oleh karena itu, dapat disebut bom dan air yang terendam sebagai sebuah sistem yang terisolasi. Karena tidak ada kalor masuk ataupun meninggalkan sistem selama proses berlangsung, perubahan kalor dari sistem (qsis) harus nol dan dapat ditulis
qsis = qkal + qrx (6.14)
= 0
dimana qkal adalah perubahan kalor untuk kalorimetri dan qrx adalah perubahan kalor untuk reaksi. Sehingga,
qrx = -qkal (6.15)
Untuk menghitung qkal, perlu diketahui kapasitas kalor dari kalorimeter (Ckal) dan kenaikan suhu, yaitu,
qkal = CkalΔt (6.16)
Kuantitas Ckal dikalibrasi dengan membakar zat yang telah diketahui dengan akurat kalor pembakarannya. Sebagai contoh, diketahui bahwa pembakaran 1 g asam benzoat (C6H5COOH) melepas kalor 26,42 kJ. Jika kenaikan suhu menjadi 4,673°C, maka kapasitas kalor kalorimeter diberikan oleh persamaan:
Setelah Ckal telah ditentukan, kalorimeter dapat digunakan untuk mengukur kalor pembakaran zat lainnya.
Gambar 6.8. Sebuah kalorimeter bom volume tetap. Kalorimeter diisi dengan gas oksigen sebelum ditempatkan di ember. Sampel dinyalakan dengan listrik, dan kalor yang dihasilkan oleh reaksi dapat secara akurat ditentukan dengan mengukur kenaikan suhu dalam jumlah yang diketahui disekitar air.
Perhatikan bahwa karena reaksi dalam kalorimeter bom terjadi pada volume tetap daripada keadaan tekanan tetap, Perubahan kalor tidak sesuai dengan perubahan entalpi ΔH (lihat Bagian 6.4). Hal ini dimungkinkan untuk memperbaiki perubahan kalor yang diukur sehingga hasilnya sesuai dengan nilai-nilai ΔH, tetapi koreksi biasanya cukup kecil sehingga tidak akan disibukkan dengan perhitungan ini. Akhirnya, hal itu adalah menarik untuk dicatat bahwa kandungan energi dari makanan dan bahan bakar (biasanya dinyatakan dalam kalori dimana 1 kal = 4,184 J) diukur dengan kalorimeter volume tetap.
Contoh 6.6
Sebuah kuantitas 1,435 g naftalena (C10H8), zat berbau pedas yang digunakan dalam pengusir ngengat, dibakar dalam kalorimeter bom volume tetap. Akibatnya, suhu air naik dari 20,28°C menjadi 25,95°C. Jika kapasitas kalor dari bom ditambah air 10,17 kJ/ °C, hitung kalor pembakaran naftalena secara molar; yaitu menemukan kalor pembakaran molar.
Strategi
Diketahui kapasitas kalor dan kenaikan suhu, bagaimana menghitung kalor yang diserap oleh kalorimeter? Berapa kalor yang dihasilkan oleh pembakaran 1,435 g naftalena? Apa faktor konversi antara gram dan mol naftalena?
Penyelesaian
Kalor yang diserap oleh bom dan air adalah sama dengan produk dari kapasitas kalor dan perubahan suhu. Dari Persamaan (6.16), dengan asumsi tidak ada kalor yang hilang ke lingkungan, dapat ditulis
qkal = Ckal.Δt
= (10,17 kJ/°C) (25,95°C - 20,28°C)
= +57,66 kJ
karena qsis = qkal + qrx = 0, qkal = -qrx. Perubahan kalor dari reaksi adalah +57,66 kJ. Ini adalah kalor yang dilepaskan oleh pembakaran 1,435 g C10H8; Oleh karena itu, dapat ditulis faktor konversi sebagai
57,66 kJ/1,435 g C10H8
Massa molar naftalena adalah 128,2 g, sehingga kalor dari pembakaran 1 mol naftalena adalah
= -5,151 x 103 kJ/molPeriksa
Diketahui bahwa reaksi pembakaran adalah eksoterm dan bahwa massa molar naftalena jauh lebih besar dari 1,4 g, apakah jawabannya wajar? Pada keadaan reaksi, dapatkah perubahan kalor (257,66 kJ) disamakan dengan perubahan entalpi reaksi?
Kalorimetri Tekanan Tetap
Sebuah perangkat yang lebih sederhana daripada kalorimeter volume tetap adalah kalorimeter tekanan tetap, yang digunakan untuk menentukan perubahan kalor untuk reaksi bukan pembakaran. Sebuah crude kalorimeter tekanan tetap dapat dibuat dari dua buah cangkir yang terbuat dari styrofoam, seperti yang ditunjukkan pada Gambar 6.9. Perangkat ini mengukur efek kalor dari berbagai reaksi, seperti netralisasi asam-basa, serta kalor dari larutan dan kalor dari pengenceran. Karena tekanan tetap, perubahan kalor untuk proses (qrx) adalah sama dengan perubahan entalpi (ΔH). Seperti dalam kasus kalorimeter volume tetap, diperlakukan kalorimeter sebagai suatu sistem yang terisolasi. Selanjutnya, dapat diabaikan kapasitas kalor kecil dari secangkir kopi dalam perhitungan. Tabel 6.3 daftar beberapa reaksi yang telah dipelajari dengan kalorimeter tekanan tetap.
Gambar 6.9. Sebuah kalorimeter tekanan tetap yang terbuat dari dua cangkir yang terbuat dari styrofoam. Cangkir luar membantu untuk melindungi campuran bereaksi dari lingkungan. Dua larutan dari volume yang diketahui mengandung reaktan pada suhu yang sama secara hati-hati dicampur dalam kalorimeter. Kalor yang dihasilkan atau diserap oleh reaksi dapat ditentukan dengan mengukur perubahan suhu.
Contoh 6.7
Sebuah pelet timbal (Pb) memiliki massa 26,47 g pada 89,98°C ditempatkan di kalorimeter tekanan tetap dengan mengabaikan kapasitas kalor mengandung 100,0 mL air. Suhu air naik dari 22,50°C menjadi 23,17°C. Berapakan kalor jenis pelet timbal?
Strategi
Sebuah sketsa dari situasi awal dan akhir adalah sebagai berikut:
Diketahui massa air dan pelet timbal serta suhu awal dan akhir. Dengan asumsi tidak ada kalor yang hilang ke lingkungan, kita dapat menyamakan kalor yang dilepas oleh pelet menyebabkan kalor diserap oleh air. Kalor jenis air diketahui, dapat dihitung kalor jenis timbal.
Penyelesaian
Perlakukan kalorimeter sebagai sistem terisolasi (tidak ada kalor yang hilang ke lingkungan), dapat ditulis
qPb + qH₂O = 0 atau
qPb = -qH₂O
Kalor yang diserap air diberikan oleh
qH₂O = m.c.Δt di mana m adalah massa air dan c adalah kalor jenis dan Δt
= takhir - tawal . Karena itu,
qH₂O = (100,0 g) (4,184 J/g°C) (23,17°C - 22,50°C)
= 280,3 J
Karena kalor dilepas oleh pelet timbal adalah sama dengan kalor yang diterima oleh air, sehingga qPb = -280,3 J. Penyelesaian untuk kalor jenis Pb, dapat ditulis
qPb = m.c.Δt-280,3J = (26,47 g) (s) (23,17°C - 89,98°C)
c = 0,158 J/g°C
Periksa kalor jenis logam yang ditunjukkan pada Tabel 6.2.
Contoh 6.8
Sebuah kuantitas 1,00 x 10² ml 0,500 M HCl dicampur dengan 1,00 x 10² mL 0,500 NaOH M dalam kalorimeter tekanan tetap, kapasitas kalor diabaikan. Suhu awal dari larutan HCl dan NaOH adalah sama, 22,50°C, dan suhu akhir dari campuran larutan adalah 25,86°C. Hitung perubahan kalor untuk reaksi netralisasi secara molar.
Sebuah kuantitas 1,00 x 10² ml 0,500 M HCl dicampur dengan 1,00 x 10² mL 0,500 NaOH M dalam kalorimeter tekanan tetap, kapasitas kalor diabaikan. Suhu awal dari larutan HCl dan NaOH adalah sama, 22,50°C, dan suhu akhir dari campuran larutan adalah 25,86°C. Hitung perubahan kalor untuk reaksi netralisasi secara molar.
NaOH(aq) + HCl(aq) àNaCl(aq) + H₂O(l)
Asumsikan bahwa kepadatan (densitas) dan kalor jenis larutan adalah sama seperti untuk air (1,00 g / mL dan 4,184 J/g°C).
Strategi
Karena suhu naik, reaksi netralisasi adalah eksotermis. Bagaimana menghitung kalor yang diserap oleh campuran larutan? Berapakah kalor reaksi? Apa faktor konversi untuk mengekspresikan kalor reaksi secara molar?
Penyelesaian
Dengan asumsi tidak ada kalor yang hilang ke lingkungan, qsis = qlar + qrx = 0, sehingga qrx = -qlar, di mana qlar adalah kalor yang diserap oleh campuran larutan. Karena kepadatan larutan adalah 1,00g/mL, massa larutan 100 mL adalah 100 g. Sehingga,
qlar = m.c.Δt
= (1,00 x 10²g + 1,00 x 10² g) (4,184 J/gºC) (25,86ºC – 22,50ºC)
= 2,81 x 103 J
= 2,81 kJ
karena qrx = -qlar, maka qrx = -2,81 kJ
Dari molaritas yang diberikan, jumlah mol dari kedua larutan HCl dan NaOH dalam 1,00 x 10² mL adalah
0,500 mol/1L x 0,100 L = 0,05 mol
Oleh karena itu, kalor netralisasi ketika 1,00 mol HCl bereaksi dengan 1,00 mol NaOH adalah
kalor netralisasi = -2,81 kJ /0,05 mol = -56,2 kJ/mol
Periksa
Apakah tanda konsisten dengan sifat dari reaksi? Pada keadaan reaksi, dapatkah perubahan kalor disamakan dengan perubahan entalpi?