Manusia hidup di dasar lautan udara yang komposisinya sekitar 78% gas N₂, 21% gas O₂, dan 1% gas lainnya, termasuk CO₂. Saat ini, sifat-sifat kimia dari campuran gas-gas penting ini telah menjadi sumber minat besar karena pengaruhnya terhadap kerusakan dan pencemaran lingkungan. Kimia atmosfer dan gas pencemar dibahas dalam Bab 17. Di bab ini akan difokuskan secara umum pada perilaku zat yang bewujud gas pada keadaan standar atau keadaan atmosfer normal, yang didefinisikan sebagai 25°C dan tekanan 1 atmosfer (atm).
Gambar 5.1 menunjukkan unsur-unsur yang berwujud gas pada keadaan atmosfer normal. Pertimbangkan bahwa gas hidrogen, nitrogen, oksigen, florin, dan klorin ada sebagai molekul diatomik: H₂, N₂, O₂, F₂, dan Cl₂. Alotrop oksigen, yaitu ozon (O₃), juga berwujud gas pada suhu kamar. Semua unsur dalam Golongan 8A, yaitu gas mulia, adalah gas monatomik: He, Ne, Ar, Kr, Xe, dan Rn.
Gambar 5.1 Unsur yang berwujud gas pada 25ºC dan 1 atm. Gas mulia (unsur Golongan 8A) adalah spesi monatomik; unsur-unsur gas lain berada sebagai molekul diatomik. Ozon (O₃) juga merupakan gas.
Tabel 5.1 Beberapa Zat Ditemukan Berwujud Gas pada 1 atm dan 25°C
Senyawa ionik tidak ada yang berwujud gas pada 25°C dan 1 atm, karena kation dan anion dalam padatan ionik disatukan oleh kekuatan elektrostatik yang sangat kuat; yaitu, kekuatan antara muatan positif dan negatif. Untuk mengatasi atraksi ini harus diterapkan sejumlah besar energi, yang dalam praktiknya dengan cara memanaskan benda padat menggunakan kekuatan panas yang tinggi. Dalam kondisi normal, yang bisa dilakukan hanyalah melelehkan padatan; misalnya, NaCl meleleh pada suhu agak tinggi 800°C. Untuk mendidihkannya, kita harus menaikkan suhu hingga di atas 1.000°C.
Perilaku senyawa molekul (biasanya senyawa kovalen) lebih bervariasi. Beberapa — misalnya, CO, CO₂, HCl, NH₃, dan CH₄ (metana) —adalah gas, tetapi sebagian besar senyawa kovalen adalah cairan atau padatan pada suhu kamar. Namun, pada pemanasan senyawa kovalen dikonversi menjadi gas, jauh lebih mudah daripada senyawa ionik. Dengan kata lain, senyawa kovalen biasanya mendidih pada suhu yang jauh lebih rendah daripada senyawa ionik. Tidak ada aturan sederhana untuk membantu kita menentukan apakah suatu senyawa kovalen tertentu berwujud gas dalam kondisi atmosfer normal. Untuk membuat tekad seperti itu, perlu dipahami sifat dan besarnya kekuatan-kekuatan atraktif di antara molekul-molekul, yang disebut gaya antarmolekul (dibahas pada Bab 11). Secara umum, semakin kuat daya tarik ini, semakin kecil kemungkinan senyawa dapat eksis sebagai gas pada suhu normal.

Dari gas yang tercantum dalam Tabel 5.1, hanya O₂ yang penting untuk kelangsungan hidup di bumi. Hidrogen sulfida (H₂S) dan hidrogen sianida (HCN) merupakan senyawa racun yang mematikan. Beberapa lainnya, seperti CO, NO₂, O₃, dan SO₂, agak kurang beracun. Gas-gas He, Ne, dan Ar secara kimia inert; yaitu, semuanya tidak bereaksi dengan zat lain apa pun. Sebagian besar gas tidak berwarna. Pengecualian adalah F₂, Cl₂, dan NO₂. Warna gelap-coklat dari NO₂ kadang-kadang terlihat di udara yang tercemar. Semua gas memiliki karakteristik fisik berikut:
- Gas memilik volume dan bentuk menyerupai wadahnya.
- Gas merupakan wujud materi yang paling mudah dimampatkan.
- Gas-gas akan segera bercampur secara merata dan sepenuhnya jika ditempatkan pada wadah yang sama.
- Gas memiliki kerapatan jauh lebih rendah daripada cairan dan padatan.
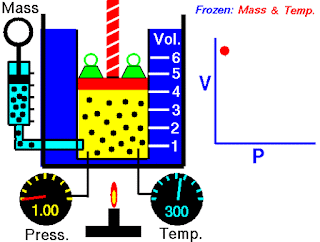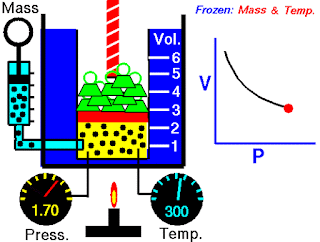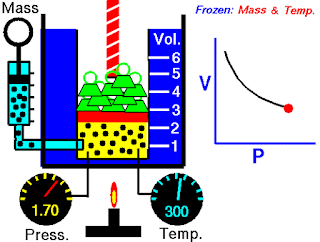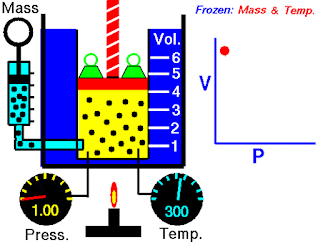
V terhadap P Pada Suhu (T) Tetap
V terhadap T Pada Tekanan (P) Tetap















No comments:
Post a Comment
Note: Only a member of this blog may post a comment.