Kelarutan sebagian besar zat juga tergantung pada pH larutan. Pertimbangkan kesetimbangan kelarutan magnesium hidroksida:
Mg(OH)₂(s) ⇋ Mg²⁺(aq) + 2OH⁻(aq)
Menambahkan ion OH⁻ (meningkatkan pH) menggeser kesetimbangan dari kanan ke kiri, sehingga menurunkan kelarutan Mg(OH)₂. (Ini adalah contoh lain dari efek ion umum.) Sebaliknya, menambahkan ion H⁺ (menurunkan pH) menggeser kesetimbangan dari kiri ke kanan, dan kelarutan Mg(OH)₂ meningkat. Dengan demikian, basa yang tidak larut cenderung larut dalam larutan asam. Demikian pula, asam tak larut cenderung larut dalam larutan basa.
Untuk mengeksplorasi pengaruh kuantitatif pH terhadap kelarutan Mg(OH)², pertama-tama dihitung pH larutan Mg(OH)² jenuh. Dapat ditulis
Ksp = [Mg²⁺][OH⁻]²=1,2 X 10⁻¹¹
Misalkan s adalah kelarutan molar dari Mg(OH)₂. Melanjutkan seperti pada Contoh 16.9,
Oleh karena itu, pada kesetimbangan,
Dalam medium dengan pH kurang dari 10,45, kelarutan Mg(OH)₂ akan meningkat. Ini mengikuti dari fakta bahwa pH yang lebih rendah menunjukkan [H⁺] yang lebih tinggi dan dengan demikian [OH⁻] yang lebih rendah, seperti yang diharapkan dari Kw=[H⁺][OH⁻]. Akibatnya, [Mg²⁺] naik untuk mempertahankan kondisi kesetimbangan, dan lebih banyak Mg(OH)₂ terlarut. Proses pelarutan dan pengaruh ion H⁺ berlebih dapat diringkas sebagai berikut:
Jika pH medium lebih tinggi dari 10,45, [OH⁻] akan lebih tinggi dan kelarutan Mg(OH)₂ akan menurun karena efek ion bersama (OH⁻).
PH juga mempengaruhi kelarutan garam yang mengandung anion basa. Misalnya, kesetimbangan kelarutan untuk BaF₂ adalah
BaF₂(s) ⇋ Ba²⁺(aq) + 2F⁻(aq)
dan
Ksp = [Ba²⁺][F⁻]²
Dalam medium asam, peningkatan [H⁺] akan menggeser kesetimbangan berikut dari kiri ke kanan:
H⁺(aq) + 2F⁻(aq) ⇋ HF(aq)
Saat [F⁻] menurun, [Ba²⁺] harus meningkat untuk menjaga kondisi ekuilibrium. Jadi, lebih banyak BaF₂ terlarut. Proses pelarutan dan pengaruh pH terhadap kelarutan BaF₂ dapat diringkas sebagai berikut:
Kelarutan garam yang mengandung anion yang tidak terhidrolisis tidak dipengaruhi oleh pH. Contoh anion tersebut adalah Cl₂, Br₂, dan I₂.
Contoh 16.13 dan 16.14 membahas pengaruh pH pada kelarutan.
Contoh 16.13
Manakah dari senyawa berikut yang akan lebih larut dalam larutan asam daripada dalam air: (a) CuS, (b) AgCl, (c) PbSO₄?
Strategi
Dalam setiap kasus, tuliskan reaksi disosiasi garam ke dalam kation dan anionnya. Kation tidak akan berinteraksi dengan ion H⁺ karena keduanya memiliki muatan positif. Anion akan bertindak sebagai akseptor proton hanya jika anion merupakan basa konjugasi dari asam lemah. Bagaimana penghilangan anion mempengaruhi kelarutan garam?
Penyelesaian
(a) Kesetimbangan kelarutan untuk CuS adalah
CuS(s) ⇋ Cu²⁺(aq) + S²⁻(aq)
Ion sulfida adalah basa konjugasi dari asam lemah HS⁻. Oleh karena itu, ion S²⁻ bereaksi dengan ion H⁺ sebagai berikut:
S²⁻(aq) + H⁺(aq) → HS⁻(aq)
Reaksi ini menghilangkan ion S²⁻ dari larutan. Menurut prinsip Le Châtelier, kesetimbangan akan bergeser ke kanan untuk menggantikan beberapa ion S²⁻ yang dihilangkan, sehingga meningkatkan kelarutan CuS.
(b) Ekuilibrium kelarutan adalah
AgCl(s) ⇋ Ag⁺(aq) + Cl⁼(aq)
Karena Cl⁻ adalah basa konjugasi dari asam kuat (HCl), kelarutan AgCl tidak dipengaruhi oleh larutan asam.
(c) Ekuilibrium kelarutan untuk PbSO₄ adalah
PbSO₄(s) ⇋ Pb²⁺(aq) + SO₄²⁻(aq)
Ion sulfat adalah basa lemah karena merupakan basa konjugasi dari asam lemah HSO₄⁻. Oleh karena itu, ion SO₄²⁻ bereaksi dengan ion H⁺ sebagai berikut:
SO₄²⁻(aq) + H⁺(aq) → HSO₄⁻(aq)
Reaksi ini menghilangkan ion SO₄²⁻ dari larutan. Menurut prinsip Le Châtelier, kesetimbangan akan bergeser ke kanan untuk menggantikan sebagian ion SO₄²⁻ yang dihilangkan, sehingga meningkatkan kelarutan PbSO₄.
Latihan
Apakah kelarutan senyawa berikut meningkat dalam larutan asam? (a) Ca(OH)₂, (b) Mg₃(PO₄)₂, (c) PbBr₂.
Contoh 16.14
Hitung konsentrasi amonia encer yang diperlukan untuk memulai pengendapan besi (II) hidroksida dari larutan 0,0030 M FeCl₂.
Strategi
Agar besi (II) hidroksida mengendap dari larutan, produk [Fe²⁺] [OH⁻]² harus lebih besar dari Ksp-nya. Pertama, perlu dihitung [OH⁻] dari [Fe²⁺] yang diketahui dan nilai Ksp yang tercantum dalam Tabel 16.2. Ini adalah konsentrasi OH⁻ dalam larutan jenuh Fe(OH)₂. Selanjutnya, perlu dihitung konsentrasi NH₃ yang akan mensuplai konsentrasi ion OH⁻ ini. Akhirnya, konsentrasi NH₃ yang lebih besar dari nilai yang dihitung akan memulai pengendapan Fe(OH)₂ karena larutan akan menjadi jenuh.
Penyelesaian
Amonia bereaksi dengan air menghasilkan ion OH⁻, yang kemudian bereaksi dengan Fe²⁺ membentuk Fe(OH)₂. Kesetimbangannya adalah
NH₃(aq) + H₂O(l) ⇋ NH₄⁺(aq) + OH⁻(aq)
Fe²⁺(aq) + 2OH⁻(aq) ⇋ Fe(OH)₂(s)
Pertama-tama ditemukan konsentrasi OH⁻ yang di atasnya Fe(OH)₂ mulai mengendap. Dapat ditulis
Ksp = [Fe²⁺][OH⁻]²=1,6 X 10⁻¹⁴
Karena FeCl₂ adalah elektrolit kuat, [Fe²⁺] = 0,0030 M dan
Selanjutnya dihitung konsentrasi NH₃ yang akan mensuplai 2,3 X 10⁻⁶ M ion OH⁻. Misalkan x adalah konsentrasi awal NH₃ dalam mol/L. Dapat dirangkum perubahan konsentrasi yang dihasilkan dari ionisasi NH₃ sebagai berikut.
Mengganti konsentrasi kesetimbangan dalam ekspresi konstanta ionisasi (lihat Tabel 15.4),
Memecahkan x, didapatkan x:
x = 2,6 x 10⁻⁶ M
Oleh karena itu, konsentrasi NH₃ harus sedikit lebih besar dari 2,6 x 10⁻⁶ M untuk memulai pengendapan Fe(OH)₂.
Latihan
Hitung apakah akan terbentuk endapan jika 2,0 mL NH₃ 0,60 M ditambahkan ke 1,0 L ZnSO₄ 1,0 x 10⁻³ M .
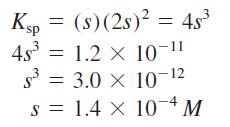


















No comments:
Post a Comment
Note: Only a member of this blog may post a comment.