Dalam bagian bab 9.5 kita mempelajari bahwa hidrogen fluorida adalah senyawa kovalen dengan ikatan polar. Ada pergeseran kerapatan elektron dari H ke F karena atom F lebih elektronegatif daripada atom H (lihat Gambar 9.4). Pergeseran kerapatan elektron disimbolkan dengan menempatkan panah silang (⇸) di atas struktur Lewis untuk menunjukkan arah pergeseran. Sebagai contoh,
Pemisahan muatan konsekuen dapat direpresentasikan sebagai
di mana 𝝳 (delta) menunjukkan muatan parsial. Pemisahan muatan ini dapat dikonfigurasikan dalam bidang listrik (Gambar 10.3). Ketika medan dihidupkan, molekul HF mengarahkan ujung negatifnya ke arah pelat positif dan ujung positifnya ke arah pelat negatif. Penjajaran molekul ini dapat dideteksi secara eksperimen.
Ukuran kuantitatif polaritas ikatan adalah momen dipolnya (𝞵), yang merupakan produk dari muatan 𝚀 dan jarak 𝚛 antara muatan:
𝞵 = 𝚀 x 𝚛
Untuk menjaga netralitas listrik, muatan pada kedua ujung molekul diatomik yang netral secara listrik harus sama besar dan berlawanan dalam tanda. Namun, dalam Persamaan (10.1), 𝚀 hanya merujuk pada besarnya muatan dan bukan pada tandanya, jadi 𝞵 selalu positif. Momen dipol biasanya dinyatakan dalam satuan debye (D), dinamai untuk mengingat Peter Debye†. Faktor konversi adalah
1 D = 3,336 x 10⁻³⁰ C m
di mana C adalah Coulomb dan m adalah meter.
Gambar 10.3 Perilaku molekul polar (a) tanpa adanya medan listrik eksternal dan (b) ketika medan listrik dihidupkan. Molekul nonpolar tidak terpengaruh oleh medan listrik.
Molekul diatomik yang mengandung atom unsur yang berbeda (misalnya, HCl, CO, dan NO) memiliki momen dipol dan disebut molekul polar. Molekul diatomik yang mengandung atom dari unsur yang sama (misalnya, H₂, O₂, dan F₂) adalah contoh molekul nonpolar karena mereka tidak memiliki momen dipol. Untuk molekul yang terdiri dari tiga atau lebih atom, baik polaritas ikatan dan geometri molekul menentukan apakah ada momen dipol. Bahkan jika ada ikatan polar, molekul tidak harus memiliki momen dipol. Karbon dioksida (CO₂) misalnya, adalah molekul triatomik, jadi geometrinya linear atau bengkok:
Panah menunjukkan pergeseran densitas elektron dari atom karbon yang kurang elektronegatif ke atom oksigen yang lebih elektronegatif. Dalam setiap kasus, momen dipol dari seluruh molekul terdiri dari dua momen ikatan, yaitu momen dipol individu dalam ikatan polar C=O. Momen ikatan adalah jumlah vektor, yang berarti memiliki momen dan arah. Momen dipol yang diukur sama dengan jumlah vektor momen ikatan. Dua momen ikatan dalam CO₂ sama besarnya. Karena keduanya menunjuk ke arah yang berlawanan dalam molekul CO₂ linear, jumlah atau momen dipol yang dihasilkan akan sama dengan nol. Di sisi lain, jika molekul CO₂ tertekuk, kedua momen ikatan sebagian akan saling memperkuat, sehingga molekul akan memiliki momen dipol. Secara eksperimen ditemukan bahwa karbon dioksida tidak memiliki momen dipol. Oleh karena itu, kita menyimpulkan bahwa molekul karbon dioksida adalah linear. Sifat linear karbon dioksida telah dikonfirmasi melalui pengukuran eksperimen lainnya.
Selanjutnya mari kita perhatikan molekul NH₃ dan NF₃ yang ditunjukkan pada Gambar 10.4. Dalam kedua kasus, atom pusat N memiliki pasangan elektron bebas, yang kepadatan muatannya jauh dari atom N.
Gambar 10.4 Momen ikatan dan momen dipol yang dihasilkan di NH₃ dan NF₃. Peta potensial elektrostatik menunjukkan distribusi kerapatan elektron dalam molekul-molekul ini.
Tabel 10.3 Momen Dipol dari Beberapa Molekul Polar
Gambar 9.5 menunjukkan bahwa N lebih elektronegatif daripada H, dan F lebih elektronegatif daripada N. Untuk alasan ini, pergeseran kerapatan elektron pada NH₃ adalah ke arah N sehingga berkontribusi pada momen dipol yang lebih besar, sedangkan momen ikatan NF diarahkan menjauh dari atom N dan bersama-sama keduanya mengimbangi kontribusi pasangan elektron bebas ke momen dipol. Dengan demikian, momen dipol yang dihasilkan NH₃ lebih besar dari pada NF₃.
Momen dipol dapat digunakan untuk membedakan antara molekul yang memiliki rumus yang sama tetapi struktur yang berbeda. Misalnya, molekul berikut keduanya ada; mereka memiliki rumus molekul yang sama (C₂H₂Cl₂), jumlah dan jenis ikatan yang sama, tetapi struktur molekul yang berbeda:
Karena cis-dikloroetilena adalah molekul polar tetapi trans-dikloroetilena bukan, keduanya dapat dengan mudah dibedakan dengan pengukuran momen dipol. Selain itu, seperti yang akan kita lihat di Bab 11, kekuatan gaya antarmolekul sebagian ditentukan oleh apakah molekul memiliki momen dipol. Tabel 10.3 mencantumkan momen dipol dari beberapa molekul polar.
Contoh 10.2 menunjukkan bagaimana kita dapat memprediksi apakah suatu molekul memiliki momen dipol jika kita mengetahui geometri molekulnya.
Contoh 10.2
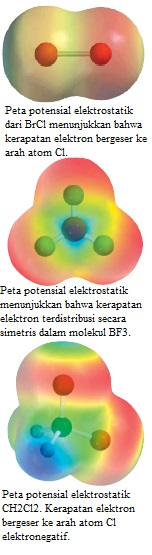
Prediksi apakah masing-masing molekul berikut memiliki momen dipol: (a) BrCl, (b) BF₃ (trigonal planar), (c) CH₂Cl₂ (tetrahedral).
Strategi
Ingatlah bahwa momen dipol suatu molekul tergantung pada perbedaan keelektronegatifan unsur-unsur yang ada dan geometrinya. Suatu molekul dapat memiliki ikatan polar (jika atom yang terikat memiliki keelektronegatifan yang berbeda), tetapi ia mungkin tidak memiliki momen dipol jika memiliki geometri yang sangat simetris.
Penyelesaian
(a) Karena bromin klorida bersifat diatomik, ia memiliki geometri linear. Klorin lebih elektronegatif daripada brom (lihat Gambar 9.5), sehingga BrCl bersifat polar dengan klor pada ujung negatifnya.
Dengan demikian, molekulnya memang memiliki momen dipol. Faktanya, semua molekul diatomik yang mengandung unsur berbeda memiliki momen dipol.
(b) Karena fluorin lebih elektronegatif daripada boron, masing-masing ikatan B-F dalam BF₃ (boron trifluorida) adalah polar dan tiga momen ikatan adalah sama. Namun, simetri bentuk trigonal planar berarti bahwa tiga momen ikatan justru saling membatalkan satu sama lain:
Analogi adalah objek yang ditarik ke arah yang ditunjukkan oleh tiga momen ikatan. Jika gaya sama, objek tidak akan bergerak. Akibatnya, BF₃ tidak memiliki momen dipol; BF₃ adalah molekul nonpolar.
(c) Struktur Lewis dari CH₂Cl₂ (metilena klorida) adalah
Molekul ini mirip dengan CH₄ karena memiliki bentuk tetrahedral secara keseluruhan. Namun, karena tidak semua ikatan itu identik, ada tiga sudut ikatan yang berbeda: HCH, HCCl, dan ClCCl. Sudut ikatan ini mendekati, tetapi tidak sama dengan, 109,58º. Karena klorin lebih elektronegatif daripada karbon, yang lebih elektronegatif daripada hidrogen, momen ikatan tidak dibatalkan dan molekul memiliki momen dipol:
Jadi, CH₂Cl₂ adalah molekul polar.
Latihan
Apakah molekul AlCl₃ memiliki momen dipol?
Ulasan Konsep
Karbon dioksida memiliki geometri linier dan nonpolar. Namun kita tahu bahwa molekul melakukan gerakan membungkuk dan meregangkan yang menciptakan momen dipol. Bagaimana Anda mendamaikan deskripsi yang saling bertentangan tentang CO₂ ini?

























No comments:
Post a Comment
Note: Only a member of this blog may post a comment.