Setelah membahas massa atom dan massa molekul, sekarang kita beralih ke peristiwa yang terjadi pada level mikroskopik atom, molekul dan ion dalam reaksi kimia. Reaksi kimia adalah suatu proses di mana suatu zat (atau senyawa) diubah menjadi satu atau lebih senyawa baru. Untuk berkomunikasi satu sama lain tentang reaksi kimia, para ahli kimia telah menemukan cara standar untuk menggambarkan reaksi kimia menggunakan level simbolik persamaan kimia. Persamaan kimia menggunakan simbol-simbol kimia untuk menunjukkan peristiwa yang terjadi pada level mikroskopik atom, molekul dan ion selama reaksi kimia. Pada bagian ini kita akan belajar bagaimana menulis persamaan kimia dan menyetarakannya.
Menulis Persamaan Kimia
Pikirkan peristiwa yang terjadi ketika gas hidrogen (H₂) terbakar di udara (yang mengandung oksigen atau O₂) menghasilkan air (H₂O). Reaksi ini dapat digambarkan dengan persamaan kimia:
H₂ + O₂ → H₂O (3.2)
di mana tanda "plus" berarti "bereaksi dengan" dan panah berarti "menghasilkan." Dengan demikian, ungkapan simbolik ini dapat dibaca: "Molekul hidrogen bereaksi dengan molekul oksigen menghasilkan air." Reaksi diasumsikan berlangsung dari kiri ke kanan seperti tanda panah.
Persamaan (3.2) tidak lengkap, karena ada dua kali lebih banyak atom oksigen di sisi kiri panah (dua) dari pada sisi kanan (satu). Untuk menyetarakan berdasarkan hukum kekekalan massa, harus ada jumlah yang sama untuk setiap jenis atom di kedua sisi tanda panah; artinya, kita harus memiliki jumlah atom yang sama setelah reaksi berakhir seperti sebelum reaksi. Kita dapat menyetarakan Persamaan (3.2) dengan menempatkan koefisien yang tepat (dalam kasus ini 2) di depan H₂ dan H₂O:
Gambar 3.7 Tiga cara untuk merepresentasikan pembakaran hidrogen. Sehubungan dengan hukum kekekalan massa, jumlah setiap jenis atom harus sama pada setiap sisi tanda panah.
Persamaan kimia yang setara ini menunjukkan bahwa "dua molekul hidrogen dapat bergabung atau bereaksi dengan satu molekul oksigen membentuk dua molekul air" (Gambar 3.7). Karena rasio jumlah molekul sama dengan rasio jumlah mol, persamaan juga dapat dibaca sebagai “2 mol molekul hidrogen bereaksi dengan 1 mol molekul oksigen menghasilkan 2 mol molekul air.” Kita mengetahui massa satu mol dari masing-masing zat ini, sehingga kita juga dapat menafsirkan persamaan kimia sebagai berikut: "4,04 g H₂ bereaksi dengan 32,00 g O₂ menghasilkan 36,04 g H₂O." Ketiga cara membaca persamaan ini dirangkum dalam Tabel 3.1.
Tabel 3.1
Penafsiran Persamaan Kimia
2H₂
|
+ O₂
|
→
|
2H₂O
|
Dua molekul
|
Satu molekul
|
→
|
Dua molekul
|
2 mol
|
1 mol
|
→
|
2 mol
|
2(2,02 g) = 4,04 g
|
32,00 g
|
→
|
2(18,02 g) = 36,04 g
|
36,04 g
reaktan
|
36,04 g produk
|
||
Kita menyebut H₂ dan O₂ dalam Persamaan (3.2) sebagai reaktan, yang merupakan bahan awal dalam reaksi kimia. Air adalah produk, yang merupakan senyawa yang terbentuk sebagai hasil dari reaksi kimia. Jadi, Persamaan kimia hanyalah gambaran singkat dari suatu reaksi kimia. Dalam persamaan kimia, biasanya reaktan ditulis di sebelah kiri dan produk di sebelah kanan tanda panah:
Reaktan → Produk
Untuk memberikan informasi tambahan, ahli kimia sering menunjukkan keadaan fisik (wujud zat) reaktan dan produk dengan menggunakan huruf g, l, dan s untuk menunjukkan wujud gas, cair, dan padat. Sebagai contoh,
2CO(g) + O₂(g) → 2CO₂(g)
2HgO(s) → 2Hg(l) + O₂(g)
Untuk menggambarkan peristiwa yang terjadi ketika natrium klorida (NaCl) ditambahkan ke dalam air, kita menulis
dimana aq menunjukkan larutan dalam air (aqueous). Menulis H₂O di atas panah melambangkan proses fisika pelarutan suatu zat dalam air, meskipun kadang-kadang ditinggalkan untuk penyederhanaan.
Mengetahui keadaan (wujud) reaktan dan produk sangat berguna ketika bekerja di laboratorium. Sebagai contoh, ketika kalium bromida (KBr) dan perak nitrat (AgNO₃) bereaksi dalam lingkungan berair, perak bromida (AgBr) padat terbentuk. Reaksi ini dapat diwakili dengan persamaan:
KBr(aq) + AgNO₃(aq) → KNO₃(aq)
+ AgBr(s)
Jika keadaan fisik reaktan dan produk tidak diberikan, orang yang belum berpengalaman mungkin mencoba untuk mereaksikan dengan mencampurkan KBr padat dengan AgNO₃ padat. Padatan ini akan bereaksi sangat lambat atau tidak sama sekali. Membayangkan proses pada tingkat mikroskopik, kita dapat memahami bahwa untuk menghasilkan produk seperti perak bromida, ion Ag⁺ dan Br⁻ harus bersentuhan satu sama lain. Tetapi, ion-ion ini terkunci di tempat dalam senyawa padatnya dan memiliki sedikit mobilitas. (Ini adalah contoh bagaimana kita menjelaskan suatu fenomena dengan memikirkan tentang apa yang terjadi pada tingkat molekul, sebagaimana dibahas dalam Bagian 1.2.)
Menyetarakan Persamaan Kimia
Misalkan kita ingin menulis persamaan untuk menggambarkan reaksi kimia yang baru saja kita lakukan di laboratorium. Bagaimana seharusnya kita melakukannya? Karena kita mengetahui identitas reaktan, kita bisa menulis rumus kimianya. Identitas produk lebih sulit ditentukan. Untuk reaksi sederhana seringkali dimungkinkan untuk memprediksi produk. Untuk reaksi yang lebih rumit yang melibatkan tiga atau lebih produk, ahli kimia mungkin perlu melakukan uji lebih lanjut untuk menetapkan keberadaan senyawa tertentu.
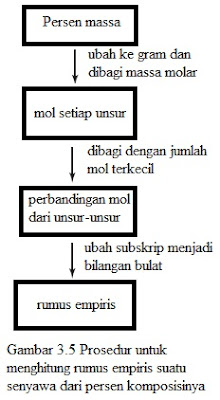
Setelah kita mengidentifikasi semua reaktan dan produk dan telah menulis rumus kimia yang benar untuk masing-masing, kita mengelompokkannya secara konvensional — reaktan di sebelah kiri tanda panah dan produk di sebelah kanan. Persamaan yang ditulis pada titik ini cenderung tidak setara; yaitu, jumlah masing-masing jenis atom pada satu sisi tanda panah berbeda dari jumlah di sisi yang lain. Secara umum, kita dapat menyetarakan persamaan kimia dengan langkah-langkah berikut:
- Identifikasi semua reaktan dan produk dan tuliskan rumus kimia yang benar di sisi kiri dan sisi kanan tanda panah.
- Mulailah menyetarakan persamaan dengan mencoba koefesien yang berbeda untuk membuat jumlah atom dari setiap unsur sama pada kedua sisi tanda panah. Kita dapat mengubah koefisien (angka yang didepan rumus kimia) tetapi bukan subskrip (angka indeks bawah dalam rumus kimia). Mengubah subskrip akan mengubah identitas senyawa. Misalnya, 2NO₂ berarti “dua molekul nitrogen dioksida,” tetapi jika kita mengalikan subskrip, kita memiliki N₂O₄, yang merupakan rumus dinitrogen tetraoksida, kedua senyawa ini benar-benar berbeda.
- Pertama-tama, carilah unsur-unsur yang hanya muncul sekali di setiap sisi tanda panah dengan jumlah atom yang sama di setiap sisi: Rumus yang mengandung unsur-unsur ini harus memiliki koefisien yang sama. Oleh karena itu, tidak perlu menyetarakan koefisien unsur-unsur ini pada langkah ini. Selanjutnya, carilah unsur-unsur yang muncul hanya sekali pada setiap sisi tanda panah tetapi dalam jumlah atom yang tidak sama. Setarakan unsur-unsur ini. Akhirnya, unsur-unsur yang setara muncul dalam dua atau lebih rumus kimia pada kedua sisi tanda panah.
- Periksa persamaan setara tersebut untuk memastikan bahwa kita memiliki jumlah total yang sama untuk setiap jenis atom di kedua sisi tanda panah persamaan.
Mari kita perhatikan contoh khusus. Di laboratorium, sejumlah kecil gas oksigen dapat disiapkan dengan memanaskan kalium klorat (KClO₃). Produknya adalah gas oksigen (O₂) dan kalium klorida (KCl). Dari informasi ini, kita menulis
KClO₃ → KCl + O₂
(Untuk penyederhanaan, kita menghilangkan keadaan fisik reaktan dan produk.) Ketiga unsur (K, Cl, dan O) hanya muncul sekali pada setiap sisi tanda panah, tetapi hanya untuk K dan Cl kita memiliki jumlah atom yang sama pada kedua sisi tanda panah. Dengan demikian, KClO₃ dan KCl harus memiliki koefisien yang sama. Langkah selanjutnya adalah membuat jumlah atom O sama pada kedua sisi tanda panah. Karena ada tiga atom O di sebelah kiri dan dua atom O di sebelah kanan tanda panah, kita dapat menyetarakan atom O dengan menempatkan 2 di depan KClO₃ dan 3 di depan O₂.
2KClO₃ → KCl + 3O₂
Akhirnya, kita menyetarakan atom K dan Cl dengan menempatkan 2 di depan KCl:
2KClO₃ → 2KCl + 3O₂ (3.3)
Sebagai pemeriksaan terakhir, kita dapat menyusun neraca untuk reaktan dan produk di mana angka dalam tanda kurung menunjukkan jumlah atom dari setiap unsur:
Reaktan
|
Produk
|
K (2)
|
K (2)
|
Cl (2)
|
Cl (2)
|
O (6)
|
O (6)
|
Perhatikan bahwa persamaan ini juga bisa disetarakan dengan koefisien yang dikalikan 2 (untuk KClO₃), 2 (untuk KCl), dan 3 (untuk O₂); sebagai contoh,
4KClO₃ → 4KCl + 6O₂
Namun, ini adalah praktik umum untuk menggunakan sekumpulan koefisien jumlah-total yang paling sederhana untuk menyetarakan persamaan. Persamaan (3.3) sesuai dengan perjanjian ini.
Sekarang mari kita perhatikan pembakaran dari komponen gas alam etana (C₂H₆) dalam oksigen atau udara, yang menghasilkan karbon dioksida (CO₂) dan air. Persamaan yang tidak setara adalah
C₂H₆ + O₂ → CO₂ + H₂O
Kita melihat bahwa jumlah atom tidak sama pada kedua sisi tanda panah untuk setiap unsur (C, H, dan O). Selain itu, C dan H hanya muncul sekali di setiap sisi tanda panah; O muncul dalam dua senyawa di sisi kanan tanda panah (CO₂ dan H₂O). Untuk menyetarakan atom C, kita menempatkan 2 di depan CO₂:
C₂H₆ + O₂ → 2CO₂ + H₂O
Untuk menyetarakan atom H, kita menambahkan koefesien 3 di depan H₂O:
C₂H₆ + O₂ → 2CO₂ + 3H₂O
Pada tahap ini, atom C dan H setara, tetapi atom O tidak karena ada tujuh atom O di sisi kanan dan hanya dua atom O di sisi kiri tanda panah. Ketidaksetaraan atom O ini dapat dihilangkan dengan menulis 7/2 di depan O2 di sisi kiri:
"Logika" untuk menggunakan 7/2 sebagai koefisien adalah bahwa ada tujuh atom oksigen di sisi kanan tanda panah persamaan, tetapi hanya sepasang atom oksigen (O₂) di sebelah kiri. Untuk menyetarakannya, kita bertanya berapa banyak atom oksigen yang diperlukan untuk menyamai tujuh atom oksigen. Sama seperti 3,5 pasang sepatu yang sama dengan tujuh sepatu, 7/2 molekul O₂ sama dengan tujuh atom O. Seperti yang ditunjukkan penghitungan berikut, persamaannya kini setara:
Reaktan
|
Produk
|
C (2)
|
C (2)
|
H (6)
|
H (6)
|
O (7)
|
O (7)
|
Namun, kita biasanya lebih memilih untuk menyatakan koefisien sebagai bilangan bulat daripada sebagai pecahan. Oleh karena itu, kita mengalikan seluruh persamaan dengan 2 untuk mengubah 7/2 menjadi 7:
2C₂H₆ + 7O₂ → 4CO₂ + 6H₂O
Penghitungan terakhir adalah
Reaktan
|
Produk
|
C (4)
|
C (4)
|
H (12)
|
H (12)
|
O (14)
|
O (14)
|
Perhatikan bahwa koefisien yang digunakan dalam menyetarakan persamaan terakhir adalah sekumpulan bilangan terkecil yang mungkin.
Dalam Contoh 3.12 kita akan terus mempraktekkan keterampilan penyetaraan persamaan kimia.
Contoh 3.12
Ketika logam aluminium terkena udara, lapisan pelindung aluminium oksida (Al₂O₃) terbentuk di permukaannya. Lapisan ini mencegah reaksi lebih lanjut antara aluminium dan oksigen, dan itu adalah alasan bahwa kaleng minuman aluminium tidak menimbulkan korosi. [Dalam kasus besi, berkarat, atau besi (III) oksida, bentuk-bentuk itu terlalu berpori untuk melindungi besi-besi di bawahnya, sehingga berkarat berlanjut.] Tuliskan persamaan setara untuk pembentukan Al₂O₃.
Strategi
Ingat bahwa rumus unsur atau senyawa tidak dapat diubah saat menyetarakan persamaan kimia. Persamaan ini disetarakan dengan menempatkan koefisien yang sesuai di depan rumus kimia. Ikuti prosedur yang dijelaskan pada bagian atas tadi.
Penyelesaian
Persamaan yang tidak setara adalah
Al + O₂ → Al₂O₃
Dalam persamaan yang setara, jumlah dan jenis atom di setiap sisi tanda panah persamaan harus sama. Kita melihat bahwa ada satu atom Al di sisi reaktan dan ada dua atom Al di sisi produk. Kita dapat menyetarakan atom Al dengan menempatkan koefisien 2 di depan Al pada sisi reaktan.
2Al + O₂ → Al₂O₃
Ada dua atom O di sisi reaktan, dan tiga atom O pada sisi produk dari persamaan. Kita dapat menyetarakan atom O dengan menempatkan koefisien 3/2 di depan O₂ pada sisi reaktan.
Ini adalah persamaan yang setara. Namun, persamaan biasanya diisetarakan dengan sekumpulan koefesien yang bulat dan sederhana. Mengalikan kedua sisi persamaan dengan 2 memberikan koefisien jumlah keseluruhan.
4Al + 3O₂ → 2Al₂O₃
Periksa
Agar persamaan setara, jumlah dan jenis atom di setiap sisi tanda panah pada persamaan harus sama. Penghitungan terakhir adalah
Reaktan
|
Produk
|
Al (4)
|
Al (4)
|
O (6)
|
O (6)
|
Persamaannya setara. Juga, koefisien direduksi menjadi himpunan bilangan bulat yang paling sederhana.
Latihan
Setarakan persamaan yang menggambarkan reaksi antara besi (III) oksida (Fe₂O₃) dan karbon monoksida (CO) menghasilkan besi (Fe) dan karbon dioksida (CO₂).