Ketika ilmu kimia baru dimulai dan jumlah senyawa yang diketahui masih sedikit, adalah mungkin untuk menghafal nama-nama senyawanya. Banyak nama senyawa berasal dari penampilan fisika, sifat, asal, atau kegunaannya — misalnya, air, garam dapur, batu kapur, soda api, soda pencuci, dan soda kue.
Hari ini jumlah senyawa yang telah diketahui lebih dari 20 juta. Untungnya, mahasiswa tidak perlu menghafal semua nama-namanya. Selama bertahun-tahun, para ahli kimia telah berusaha menemukan sistem yang jelas untuk menamai zat-zat kimia. Aturan ini diterima di seluruh dunia, memfasilitasi komunikasi di antara ahli kimia dan menyediakan cara yang berguna untuk memberi label berbagai zat yang luar biasa. Menguasai aturan-aturan ini sekarang akan terbukti bermanfaat segera ketika kita melanjutkan dengan pelajaran kimia.
Untuk memulai diskusi tentang tata nama senyawa kimia (menamai senyawa kimia), kita harus terlebih dahulu membedakan antara senyawa anorganik dan senyawa organik. Senyawa organik mengandung karbon, biasanya dikombinasikan dengan unsur-unsur seperti hidrogen, oksigen, nitrogen, dan belerang. Semua senyawa lainnya diklasifikasikan sebagai senyawa anorganik. Untuk kenyamanan, beberapa senyawa yang mengandung karbon, seperti karbon monoksida (CO), karbon dioksida (CO2), karbon disulfida (CS2), senyawa yang mengandung gugus sianida (CN2), dan karbonat (CO32-) dan bikarbonat (HCO3-) masuk dalam kelompok senyawa anorganik. Bagian 2.8 memberikan pengantar singkat untuk senyawa organik.
Untuk mengatur dan menyederhanakan usaha kita dalam menamai senyawa, kita dapat membagi senyawa anorganik menjadi empat kategori: senyawa ionik, senyawa molekul, senyawa asam dan basa, dan senyawa hidrat.
Senyawa Ionik
Dalam bagian 2.5 kita belajar bahwa senyawa ionik terdiri dari kation (ion positif) dan anion (ion negatif). Dengan pengecualian penting ion amonium (NH4+) semua kation yang menjadi perhatian bagi kita berasal dari atom-atom logam. Kation logam diambil namanya dari nama unsurnya. Sebagai contoh,
Nama Unsur
|
Nama Kation
|
||
Na
|
Natrium
|
Na+
|
Ion Natrium
|
K
|
Kalium
|
K+
|
Ion Kalium
|
Mg
|
Magnesium
|
Mg2+
|
Ion Magnesium
|
Al
|
Aluminium
|
Al3+
|
Ion Aluminium
|
Banyak senyawa ionik adalah senyawa biner, atau senyawa yang terbentuk dari hanya dua unsur. Untuk senyawa biner, unsur pertama yang disebut adalah kation logam, diikuti oleh anion non-logam. Dengan demikian, NaCl adalah natrium klorida. Anion dinamakan dengan mengambil bagian pertama dari nama unsur (klorin) dan menambahkan akhiran "-ida." Kalium bromida (KBr), seng iodida (ZnI2), dan aluminium oksida (Al2O3) juga merupakan senyawa biner. Tabel 2.2 menunjukkan nomenklatur/tata nama "-ida" dari beberapa anion monatomik yang umum sesuai dengan posisinya dalam tabel periodik.
Tabel 2.2 Tatanama "-ida" Beberapa Anion Monoatomik
Golongan IVA
|
Golongan VA
|
Gologan VIA
|
Golongan VIIA
|
C karbida (C4-) (C22-)
|
N nitrida (N3-)
|
O oksida (O2-)
|
F fluorida (F-)
|
Si silikida (Si4-)
|
P fosfida (P3-)
|
S sulfida (S2-)
|
Cl klorida (Cl-)
|
Se selenida (Se2-)
|
Br bromida (Br-)
|
||
Te telurida (Te2-)
|
I iodida (I-)
|
Akhiran "-ida" juga digunakan untuk kelompok anion tertentu yang mengandung unsur-unsur yang berbeda, seperti hidroksida (OH2) dan sianida (CN2). Dengan demikian, senyawa LiOH dan KCN diberi nama litium hidroksida dan kalium sianida. Zat ini dan sejumlah zat ionik lainnya disebut senyawa terner, yang berarti senyawa yang terdiri dari tiga unsur. Tabel 2.3 daftar nama sejumlah kation dan anion anorganik yang umum.
Tabel 2.3 Nama dan Rumus Beberapa Kation dan Anion Anorganik
Kation
|
Anion
|
aluminium (Al3+)
|
bromide (Br-)
|
ammonium (NH4+)
|
karbonat (CO32-)
|
barium (Ba2+)
|
klorat (ClO3-)
|
kadmium (Cd2+)
|
klorida (Cl-)
|
kalsium (Ca2+)
|
kromat (CrO42-)
|
sesium (Cs+)
|
sianida (CN-)
|
kromium (III) (Cr3+)
|
dikromat (Cr2O7-)
|
kobalt (II) (Co2+)
|
dihidrogen fosfat (H2PO42-)
|
tembaga (I) (Cu+)
|
fluorida (F-)
|
tembaga (II) (Cu2+)
|
hidrida (H-)
|
hidrogen (H+)
|
hidrogen karbonat / bikarbonat (HCO3-)
|
besi (II) (Fe2+)
|
hidrogen fosfat (HPO42-)
|
besi (III) (Fe3+)
|
hidrogen sulfat / bisulfat (HSO4-)
|
timbal (II) (Pb2+)
|
hidroksida (OH-)
|
litium (Li+)
|
iodida (I-)
|
magnesium (Mg2+)
|
nitrat (NO3-)
|
mangan (II) (Mn2+)
|
nitrida (N3-)
|
merkuri (I) (Hg22+)
|
nitrit (NO2-)
|
merkuri (II) (Hg2+)
|
oksida (O2-)
|
kalium (K+)
|
permanganat (MnO4-)
|
rubidium (Rb+)
|
peroksida (O22-)
|
perak (Ag+)
|
fosfat (PO43-)
|
natrium (Na+)
|
sulfat (SO42-)
|
strontium (Sr2+)
|
sulfida (S2-)
|
timah (Sn2+)
|
sulfit (SO32-)
|
seng (Zn2+)
|
tiosianat (SCN-)
|
Logam tertentu, terutama logam transisi dapat membentuk lebih dari satu jenis kation. Ambil besi sebagai contoh. Besi dapat membentuk dua kation : Fe2+ dan Fe3+. Sistem tata nama yang lebih tua yang masih dalam penggunaan terbatas memberikan nama feri pada kation dengan muatan positif yang lebih sedikit dan fero pada kation dengan muatan positif lebih banyak:
Fe2+
|
ion fero
|
Fe3+
|
ion feri
|
Nama-nama senyawa yang dibentuk ion besi ini dengan klorin akan menjadi:
FeCl2
|
fero klorida
|
FeCl3
|
feri klorida
|
FeCl2 (kiri) dan FeCl3 (kanan)
Metode penamaan ion ini memiliki beberapa batasan yang berbeda. Pertama, akhiran “-o” dan “-i” tidak memberikan informasi mengenai muatan aktual kedua kation yang terlibat. Dengan demikian, ion feri adalah Fe3+, tetapi kation tembaga yang bernama kupri memiliki rumus Cu2+. Selain itu, akhiran “-o” dan “-i” memberikan nama hanya untuk dua kation unsur yang berbeda. Beberapa unsur logam dapat memiliki tiga atau lebih jenis kation yang berbeda dalam senyawanya. Oleh karena itu, telah menjadi semakin umum untuk menunjuk kation yang berbeda dengan angka Romawi. Ini disebut sistem Stock. Dalam sistem ini, angka Romawi I menunjukkan satu muatan positif, II berarti dua muatan positif, dan seterusnya. Sebagai contoh, atom mangan (Mn) dapat memiliki beberapa muatan positif yang berbeda:
Mn2+
|
: MnO
|
mangan (II) oksida
|
Mn3+
|
: Mn2O3
|
mangan (III) oksida
|
Mn4+
|
: MnO2
|
mangan (IV) oksida
|
Nama-nama ini diucapkan "mangan-dua oksida," "mangan-tiga oksida," dan "mangan-empat oksida." Dalam sistem Stock, ion fero dan ion feri ditunjukkan sebagai besi (II) dan besi (III), masing-masing; fero klorida untuk besi (II) klorida; dan feri klorida untuk besi (III) klorida. Sesuai dengan praktik modern, kita akan mendukung penggunaan sistem Stock untuk tata senyawa ionik.
Contoh 2.5 dan 2.6 mengilustrasikan cara memberi nama senyawa ionik dan menulis rumus untuk senyawa ionik berdasarkan informasi yang diberikan pada Gambar 2.11 dan Tabel 2.2 dan 2.3.
Contoh 2.5
Beri nama senyawa berikut:
(a) Cu(NO3)2
(b) KH2PO4
(c) NH4ClO3
Strategi
Perhatikan bahwa senyawa dalam (a) dan (b) mengandung atom-atom logam dan non logam, jadi senyawanya merupakan senyawa ionik. Tidak ada atom logam dalam (c) tetapi ada gugus amonium, yang mengandung muatan positif. Jadi NH4ClO3 juga merupakan senyawa ionik. Referensi untuk nama kation dan anion ada di Tabel 2.3. Perlu diingat bahwa atom logam dapat membentuk kation dengan muatan yang berbeda (lihat Gambar 2.11), kita perlu menggunakan sistem Stock.
Solusi
(a) Ion nitrat (NO3-) mengandung satu muatan negatif, sehingga ion tembaga harus memiliki dua muatan positif. Karena tembaga dapat membentuk ion Cu+ dan Cu2+, kita perlu menggunakan sistem Stock dan memberi nama senyawa tembaga (II) nitrat.
(b) Kationnya adalah K+ dan anionnya adalah H2PO42- (dihidrogen fosfat). Karena kalium hanya membentuk satu jenis ion (K+), tidak perlu menggunakan kalium (I) dalam nama. Senyawa ini adalah kalium dihidrogen fosfat.
(c) Kationnya adalah NH4+ (ion amonium) dan anionnya adalah ClO3-. Senyawa tersebut adalah amonium klorat.
Contoh 2.6
Tuliskan rumus kimia untuk senyawa berikut: (a) merkuri (I) nitrit, (b) cesium sulfida, dan (c) kalsium fosfat.
Strategi
Kita mengacu pada Tabel 2.3 untuk rumus kation dan anion. Ingat bahwa angka Romawi dalam sistem Stock memberikan informasi yang berguna tentang muatan kation.
Solusi
(a) Angka Romawi menunjukkan bahwa ion merkuri mengandung muatan +1. Menurut Tabel 2.3, bagaimanapun, ion merkuri (I) adalah diatomik (yaitu, Hg22+) dan ion nitrit adalah NO2-. Oleh karena itu, rumusnya adalah Hg2(NO2)2.
(b) Setiap ion sulfida mengandung dua muatan negatif, dan masing-masing ion sesium mengandung satu muatan positif (sesium di Golongan IA, seperti natrium). Oleh karena itu, rumusnya adalah Cs2S.
(c) Setiap ion kalsium (Ca2+) mengandung dua muatan positif, dan masing-masing ion fosfat (PO43-) mengandung tiga muatan negatif. Untuk membuat jumlah muatan sama dengan nol, kita harus menyesuaikan jumlah kation dan anion:
3(+2) + 2(-3) = 0
sehingga rumusnya adalah Ca3(PO4)2.
Senyawa Molekul
Tidak seperti senyawa ionik, senyawa molekul mengandung satuan molekul diskrit. Biasanya terdiri dari unsur-unsur non-logam (lihat Gambar 2.10). Banyak senyawa molekul adalah senyawa biner. Penamaan senyawa molekul biner mirip dengan penamaan senyawa ionik biner. Kita menempatkan nama unsur pertama dalam rumus pertama, dan unsur kedua diberi nama dengan menambahkan -ida pada akar dari nama unsur. Beberapa contohnya
HCl
|
hidrogen klorida
|
HBr
|
hidrogen bromida
|
SiC
|
silicon karbida
|
Sangat umum untuk sepasang unsur membentuk beberapa senyawa yang berbeda. Dalam kasus ini, kebingungan dalam penamaan senyawa dihindari dengan penggunaan awalan Yunani untuk menunjukkan jumlah atom dari setiap unsur yang ada (Tabel 2.4). Perhatikan contoh-contoh berikut:
CO
|
karbon monoksida
|
CO2
|
karbon dioksida
|
SO2
|
belerang dioksida
|
SO3
|
belerang trioksida
|
NO2
|
nitrogen dioksida
|
N2O4
|
dinitrogen trioksida
|
Tabel 2.4 Awalan Yunani Yang Digunakan Dalam Penamaan Senyawa Molekul
Awalan
|
Makna
|
mono-
|
1
|
di-
|
2
|
tri-
|
3
|
tetra-
|
4
|
penta-
|
5
|
heksa-
|
6
|
hepta-
|
7
|
okta-
|
8
|
nona-
|
9
|
deka-
|
10
|
Panduan berikut bermanfaat dalam penamaan senyawa dengan awalan:
• Awalan "mono-" dapat dihilangkan untuk unsur pertama. Sebagai contoh, PCl3 dinamai fosfor triklorida, bukan monofosfor triklorida. Dengan demikian, tidak adanya awalan untuk unsur pertama biasanya berarti hanya ada satu atom dari unsur yang ada dalam molekul.
• Untuk oksida, akhiran “a” dalam awalan kadang-kadang dihilangkan. Sebagai contoh, N2O4 dapat disebut dinitrogen tetroksida daripada dinitrogen tetraoksida.
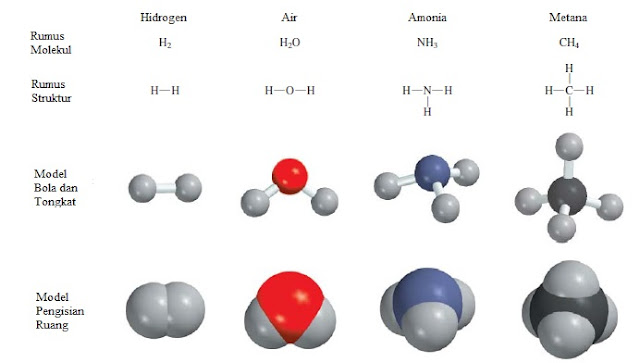
Pengecualian untuk penggunaan awalan Yunani adalah senyawa molekul yang mengandung hidrogen. Secara tradisional, banyak dari senyawa ini disebut baik oleh nama-nama non-sistematik yang umum ataupun dengan nama-nama yang tidak secara khusus menunjukkan jumlah atom-atom H yang ada:
B2H6
|
diboran
|
CH4
|
metana
|
SiH4
|
silana
|
NH3
|
amonia
|
PH3
|
fosfina
|
H2O
|
air
|
H2S
|
hidrogen sulfida
|
Perhatikan bahwa bahkan urutan penulisan unsur dalam rumus untuk senyawa hidrogen tidak teratur. Dalam air dan hidrogen sulfida, H ditulis pertama, sedangkan muncul terakhir dalam senyawa lain.
Menulis rumus untuk senyawa molekul biasanya mudah. Dengan demikian, nama arsenik trifluorida berarti bahwa ada tiga atom F dan satu atom As dalam setiap molekul, dan rumus molekulnya adalah AsF3. Perhatikan bahwa urutan unsur dalam rumus sama dengan namanya.
Contoh 2.7
Beri nama senyawa molekul berikut:
(a) SiCl4
(b) P4O10
Strategi
Kita mengacu pada Tabel 2.4 untuk awalan. Dalam (a) hanya ada satu atom Si sehingga kita tidak menggunakan awalan "mono."
Solusi
(a) Karena ada empat atom klorin yang ada, senyawa tersebut adalah silikon tetraklorida.
(b) Ada empat atom fosfor dan sepuluh atom oksigen yang ada, sehingga senyawa tersebut adalah tetrafosfor dekoksida. Perhatikan bahwa "a" dihilangkan dalam "deka."
Contoh 2.8
Tuliskan rumus kimia untuk senyawa molekul berikut:
(a) karbon disulfida
(b) disilikon heksabromida.
Strategi
Di sini kita perlu mengubah awalan pada jumlah atom (lihat Tabel 2.4). Karena tidak ada awalan untuk karbon dalam (a), itu berarti hanya ada satu atom karbon yang ada.
Solusi
(a) Karena ada dua atom belerang dan satu atom karbon, rumusnya adalah CS2.
(b) Ada dua atom silikon dan enam atom bromin hadir, sehingga rumusnya adalah Si2Br6.
Gambar 2.14 merangkum langkah-langkah untuk penamaan senyawa ionik dan molekul biner.
Gambar 2.14 Langkah-langkah untuk penamaan senyawa ionik dan molekul biner.
Asam dan Basa
Tatanama Asam
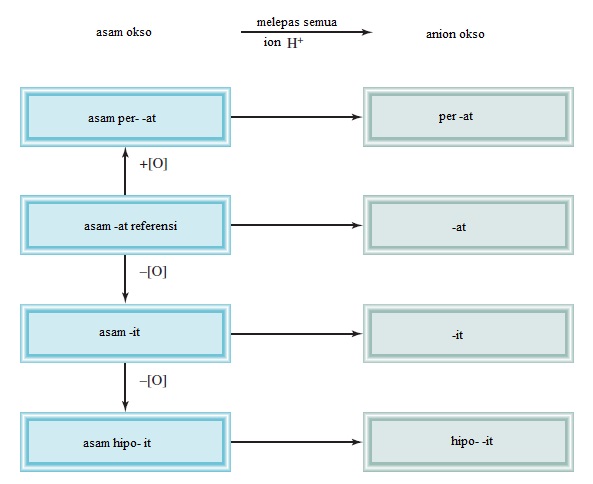
Asam dapat digambarkan sebagai zat yang menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air. (H+ setara dengan satu proton, dan sering disebut demikian.) Rumus untuk asam mengandung satu atau lebih atom hidrogen serta gugus anion. Anion yang namanya berakhiran "-ida" membentuk asam dengan awalan "hidro-" dan akhiran "-at", seperti yang ditunjukkan pada Tabel 2.5. Dalam beberapa kasus, dua nama yang berbeda tampaknya diberikan untuk rumus kimia yang sama.
HCl
|
asam klorida
|
HCl
|
asam hidroklorat
|
Nama yang ditetapkan untuk senyawa tergantung pada keadaan fisikanya. Dalam keadaan gas atau cairan murni, HCl adalah senyawa molekul yang disebut asam klorida. Ketika dilarutkan dalam air, molekul memecah menjadi ion H+ dan Cl-; dalam keadaan ini, zat ini disebut asam hidroklorat.
Asam okso adalah asam yang mengandung hidrogen, oksigen, dan unsur lain (unsur sentral). Rumus asam okso biasanya ditulis dengan H pertama, diikuti oleh unsur sentral dan kemudian O. Kita menggunakan beberapa asam referensi yang umum berikut dalam penamaan asam okso:
H2CO3
|
asam karbonat
|
HClO3
|
asam klorat
|
HNO3
|
asam nitrat
|
H3PO4
|
asam fosfat
|
H2SO4
|
asam sulfat
|
Ketika dilarutkan dalam air, molekul HCl diubah menjadi ion H+ dan Cl-. Ion H+ dikaitkan dengan satu atau lebih molekul air, dan biasanya direpresentasikan sebagai H3O+.
Seringkali dua atau lebih asam okso memiliki atom sentral yang sama tetapi sejumlah atom O yang berbeda. Dimulai dengan asam okso referensi yang namanya diakhiri dengan “-at,” menggunakan aturan berikut untuk menamai senyawa ini.
1. Penambahan satu atom O ke asam "-at" : Asam disebut asam "per. . . -at ". Dengan demikian, menambahkan atom O ke HClO3 mengubah asam klorat menjadi asam perklorat (HClO4).
2. Penghapusan satu atom O dari asam "-at" : Asam disebut asam "-it". Jadi, asam nitrat (HNO3), menjadi asam nitrit (HNO2).
3. Penghapusan dua atom O dari asam "-at" : Asam disebut asam "hipo. . . -it”. Jadi, ketika HBrO3 diubah menjadi HBrO, asam disebut asam hipobromit.
Tabel 2.5 Beberapa Asam Sederhana
Anion
|
Asam
|
F-
|
HF asam hidrofluorat
|
Cl-
|
HCl asam hidroklorat
|
Br-
|
HBr asam hidrobromat
|
I-
|
HI asam hidroiodat
|
CN-
|
HCN asam hidrosianat
|
S2-
|
H2S asam hidrosulfat
|
Gambar 2.15. Menamai asam okso dan anion okso
Aturan untuk menamai anion okso, anion dari asam okso, adalah sebagai berikut:
- Ketika semua ion H dilepaskan dari asam "-at", nama anion akan berakhir "-at." Misalnya, anion CO32- yang berasal dari H2CO3 disebut karbonat.
- Ketika semua ion H dilepaskan dari asam “-it”, nama anion akan berakhir dengan "-it" Jadi, anion ClO22- berasal dari HClO2 disebut klorit.
- Nama-nama anion di mana satu atau lebih tetapi tidak semua ion hidrogen telah dilepaskan harus menunjukkan jumlah ion H yang ada. Misalnya, pertimbangkan anion yang berasal dari asam fosfat:
H3PO4
|
asam fosfat
|
H2PO4-
|
dihidrogen fosfat
|
HPO42-
|
hidrogen fosfat
|
PO43-
|
fosfat
|
H3PO4
Perhatikan bahwa kita biasanya menghilangkan awalan "mono-" ketika hanya ada satu H dalam anion. Gambar 2.15 merangkum nomenklatur untuk asam okso dan anion okso, dan Tabel 2.6 memberikan nama-nama dari asam okso dan anion okso yang mengandung klorin.
Tabel 2.6 Nama Asam Okso dan Anion Okso Yang Mengadung Klorin
Asam
|
Anion
|
||
HClO4
|
asam perklorat
|
ClO4-
|
perklorat
|
HClO3
|
asam klorat
|
ClO3-
|
klorat
|
HClO2
|
asam klorit
|
ClO2-
|
klorit
|
HClO
|
asam hipoklorit
|
ClO-
|
hipoklorit
|
Contoh 2.9 berkaitan dengan tata nama untuk asam okso dan anion okso.
Contoh 2.9
Beri nama asam okso dan anion okso berikut:
(a) H3PO3
(b) IO4-
Strategi
Untuk menamai asam dalam (a), pertama-tama kita mengidentifikasi asam referensi, yang namanya diakhiri dengan "at" seperti yang ditunjukkan pada Gambar 2.15. Di soal (b), kita perlu mengkonversi anion ke asam asalnya yang ditunjukkan pada Tabel 2.6.
Solusi
(a) Kita mulai dengan asam referensi, asam fosfat (H3PO4). Karena H3PO3 memiliki satu atom O yang lebih sedikit, itu disebut asam fosfit.
(b) Asam induk adalah HIO4. Karena asam memiliki satu atom O lebih dari asam referensi iodat (HIO3), itu disebut asam periodat. Oleh karena itu, anion yang berasal dari HIO4 disebut periodat.
Tatanama Basa
Basa dapat digambarkan sebagai zat yang menghasilkan ion hidroksida (OH-) ketika dilarutkan dalam air. Beberapa contohnya:
NaOH
|
natrium hidroksida
|
KOH
|
kalium hidroksida
|
Ba(OH)2
|
barium hidroksida
|
Amonia (NH3), suatu senyawa molekul dalam keadaan cair atau cairan murni, juga diklasifikasikan sebagai basa yang umum. Pada pandangan pertama ini mungkin tampak pengecualian untuk definisi basa. Tetapi perhatikan bahwa selama suatu zat menghasilkan ion hidroksida ketika dilarutkan dalam air, itu tidak perlu mengandung ion hidroksida dalam strukturnya untuk dianggap sebagai basa. Bahkan, ketika amonia larut dalam air, NH3 bereaksi sebagian dengan air untuk menghasilkan ion NH4+ dan OH-. Dengan demikian, itu benar diklasifikasikan sebagai basa.
Hidrat
Hidrat adalah senyawa yang memiliki sejumlah molekul air tertentu yang melekat padanya. Misalnya, dalam keadaan normal, setiap satuan tembaga (II) sulfat memiliki lima molekul air yang terkait dengannya. Nama sistematis untuk senyawa ini adalah tembaga (II) sulfat pentahidrat, dan rumusnya ditulis sebagai CuSO4 ∙ 5H2O. Molekul air dapat dilepaskan dengan pemanasan. Ketika ini terjadi, senyawa yang dihasilkan adalah CuSO4, yang kadang-kadang disebut tembaga (II) sulfat anhidrat; "Anhidrat" berarti bahwa senyawa tidak lagi memiliki molekul air yang terkait padanya (Gambar 2.16). Beberapa hidrat lainnya:
BaCl2 ∙ 2H2O
|
barium klorida dihidrat
|
LiCl ∙ H2O
|
litium klorida monohidrat
|
MgSO4 ∙ 7H2O
|
magnesium sulfta heptahidrat
|
Sr(NO3)2 ∙ 4H2O
|
strontium nitrat tetrahidrat
|
CuSO4 ∙ 5H2O (kiri) dan CuSO4 (kanan)
Senyawa anorganik yang dikenal
Beberapa senyawa lebih dikenal dengan nama-nama umumnya di pasaran daripada oleh nama-nama kimia sistematis mereka. Contoh-contoh yang tidak lazim tercantum dalam Tabel 2.7.
Tabel 2.7 Nama Pasaran dan Nama Sistematis Beberapa Senyawa
Rumus
|
Nama Pasaran
|
Nama Sistematis
|
H2O
|
air
|
dihidrogen monoksida
|
NH3
|
amonia
|
trihidrogen nitrida
|
CO2(s)
|
es kering
|
karbon dioksida padat
|
NaCl
|
garam dapur/garam meja
|
natrium klorida
|
N2O
|
gas tertawa
|
dinitrogen monoksida
|
CaCO3
|
marmer, kapur, batu kapur
|
kalsium karbonat
|
CaO
|
kapur tohor
|
kalsium oksida
|
Ca(OH)2
|
kapur
|
kalsium hidroksida
|
NaHCO3
|
baking soda
|
natrium bikarbonat
|
Na2CO3 ∙ 10H2O
|
soda cuci
|
natrium karbonat dekahidrat
|
MgSO4 ∙ 7H2O
|
garam epsom
|
magnesium sulfat heptahidrat
|
Mg(OH)2
|
susu magnesium
|
magnesium hidroksida
|
CaSO4 ∙ 2H2O
|
gypsum
|
Kalsium sulfat dihidrat
|