Perubahan energi yang terjadi selama reaksi kimia sebagai hubungan massa akan dibahas pada bagian bab berikutnya. Sebagai contoh, reaksi pembakaran melibatkan bahan bakar seperti gas alam (LPG 3 Kg, 5Kg dan 12 Kg) dan minyak bumi (minyak tanah dan bensin) yang sering digunakan dalam kehidupan sehari-hari. Energi dilepaskan ketika gas alam dan minyak bumi dibakar menghasilkan produk air dan karbon dioksida.
Hampir semua reaksi kimia menyerap ataupun melepas energi, umumnya dalam bentuk panas (kalor). Penting untuk memahami perbedaan antara energi panas (thermal energy) dan panas (heat). Panas terjadi karena perpindahan energi panas antara dua benda pada suhu yang berbeda. Pada umumnya sering disebut sebagai "aliran panas" (kalor) dari benda bersuhu panas ke benda yang suhunya dingin. Meskipun istilah "kalor" dengan sendirinya menyiratkan perpindahan energi, umumnya lazim disebut "kalor yang diserap" atau "kalor yang dilepas" ketika digambarkan perubahan energi yang terjadi selama proses berlangsung. Termokimia adalah ilmu yang mempelajari perubahan energi dalam reaksi kimia.
Untuk menganalisis perubahan energi yang terkait dengan reaksi kimia, pertama-tama harus didefinisikan sistem, yaitu bagian tertentu dari alam semesta yang menjadi perhatian. Bagi ahli kimia, sistem biasanya termasuk zat yang terlibat dalam perubahan kimia dan fisika. Sebagai contoh, dalam sebuah percobaan reaksi netralisasi asam basa, sistem dapat berupa gelas yang berisi 50 mL HCl yang ditambahkan 50 mL NaOH. Lingkungan adalah alam semesta di luar sistem.
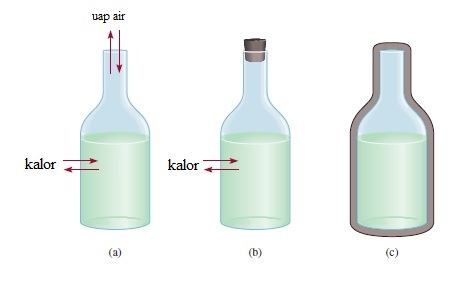
Ada tiga jenis sistem yaitu sistem terbuka, sistem tertutup dan sistem terisolasi. Sistem terbuka dapat bertukar massa dan energi (biasanya dalam bentuk kalor) dengan lingkungan. Sebagai contoh, sistem terbuka dapat terdiri dari sejumlah air di dalam wadah terbuka, seperti yang ditunjukkan pada Gambar 6.1 (a). Jika kita menutup termos, seperti pada Gambar 6.1 (b), sehingga uap air tidak dapat keluar dari wadah, sehingga menjadi sistem tertutup, yang memungkinkan perpindahan energi (kalor) tetapi tidak untuk massa. Jika air ditempatkan dalam wadah yang benar-benar terisolasi, maka sistem yang terisolasi tidak memungkinkan perpindahan baik massa maupun energi, seperti yang ditunjukkan pada Gambar 6.1 (c).
Gambar 6.1. Tiga jenis sistem diwakili oleh air dalam botol: (a) sistem terbuka, yang memungkinkan pertukaran massa dan energi dengan lingkungannya; (b) sistem tertutup, yang memungkinkan pertukaran energi tetapi tidak untuk massa; dan (c) suatu sistem yang terisolasi, yang tidak memungkinkan pertukaran energi ataupun massa (di sini termos tertutup oleh jaket vakum).
Pembakaran gas hidrogen dengan oksigen adalah salah satu dari banyak reaksi kimia yang melepaskan sejumlah besar energi (Gambar 6.2):
2H₂(g) + O₂(g) → 2H₂O(l) + energi
Gambar 6.2 Bencana Hindenburg, suatu kapal udara Jerman diisi dengan gas hidrogen, hancur dalam sebuah kebakaran spektakuler di Lakehurst, New Jersey, pada tahun 1937.
Dalam peristiwa ini, campuran yang bereaksi (hidrogen, oksigen, dan molekul air) diberi label sebagai sistem dan alam semesta di sekitar sebagai lingkungan. Karena energi tidak dapat diciptakan ataupun dimusnahkan, maka setiap energi yang dilepas oleh sistem harus diterima oleh lingkungan. Dengan demikian, kalor yang dihasilkan oleh proses pembakaran dipindahkan dari sistem ke lingkungan. Reaksi ini adalah contoh dari proses eksotermik, yaitu proses yang melepaskan kalor, perpindahan energi panas dari sistem ke lingkungan. Gambar 6.3 (a) menunjukkan perubahan energi untuk pembakaran gas hidrogen.
Sekarang perhatikan reaksi berikut ini, dekomposisi merkuri (II) oksida (HgO) pada suhu tinggi:
energi + 2HgO(s) → 2Hg(l) + O₂g)
Reaksi ini adalah proses endotermis, di mana kalor harus diserap oleh sistem (yaitu HgO) dari lingkungan [Gambar 6.3 (b)].
Gambar 6.3 menunjukkan bahwa dalam reaksi eksotermis, energi total produk lebih kecil atau kurang dari total energi reaktan. Perbedaannya adalah kalor yang disediakan oleh sistem dilepas ke lingkungan. Justru sebaliknya yang terjadi dalam reaksi endotermis. Di sini, perbedaan antara energi produk dan energi reaktan sama dengan kalor yang diserap oleh sistem dari lingkungan.
Gambar 6.3. (a) Sebuah proses eksoterm. (b) Sebuah proses endoterm.
*Bagian (a) dan (b) tidak digambarkan pada skala yang sama; kalor yang dilepaskan dalam pembentukan H₂O dari H₂ dan O₂ tidak sama dengan kalor yang diserap dalam dekomposisi HgO.
Ulasan Konsep
(b) Seorang siswa membaca di kamar asramanya.
(c) Udara di dalam bola tenis.
Ulasan Konsep
Klasifikasikan masing-masing contoh berikut sebagai sistem terbuka, sistem tertutup, atau sistem terisolasi.
(a) Susu disimpan dalam termos tertutup.(b) Seorang siswa membaca di kamar asramanya.
(c) Udara di dalam bola tenis.