Seperti yang telah kita lihat, konfigurasi elektron dari unsur-unsur menunjukkan variasi periodik dengan meningkatnya nomor atom. Akibatnya, ada juga variasi berkala dalam sifat fisik dan sifat kimia unsur. Pada bagian ini dan dua bagian berikutnya, kita akan memeriksa beberapa sifat fisik unsur yang berada dalam golongan atau periode yang sama dan sifat tambahan yang mempengaruhi sifat kimia unsur tersebut. Pertama, mari kita lihat konsep muatan inti efektif, yang memiliki pengaruh langsung pada banyak sifat atom.
Muatan Inti Efektif
Dalam Bab 7 kita membahas efek perisai yang dimiliki elektron dekat dengan inti pada elektron kulit terluar dalam atom banyak elektron. Kehadiran elektron lain dalam atom mengurangi tarikan elektrostatik antara elektron yang diberikan dan proton yang bermuatan positif di dalam inti. Muatan inti efektif (Zeff) adalah muatan inti yang dirasakan oleh elektron ketika muatan inti sebenarnya (Z) dan efek tolakan (perisai) dari elektron lain diperhitungkan. Secara umum, Zeff diberikan oleh
Zeff = Z - 𝜎 (8.2)
di mana 𝜎 (sigma) disebut konstanta pelindung (juga disebut konstanta skrining). Konstanta pelindung lebih besar dari nol tetapi lebih kecil dari Z.
Salah satu cara untuk menggambarkan bagaimana elektron dalam atom saling melindungi satu sama lain adalah dengan mempertimbangkan jumlah energi yang dibutuhkan untuk melepaskan dua elektron dari atom helium. Eksperimen menunjukkan bahwa dibutuhkan 3,94 x 10⁻¹⁸ J untuk melepas elektron pertama dan 8,72 x 10⁻¹⁸ J untuk melepas elektron kedua. Tidak ada perisai setelah elektron pertama dilepaskan, sehingga elektron kedua merasakan efek penuh dari muatan inti +2.
Karena elektron inti rata-rata lebih dekat ke inti daripada elektron valensi, elektron inti melindungi elektron valensi jauh lebih banyak daripada elektron valensi melindungi satu sama lain. Pertimbangkan unsur periode kedua dari Li ke Ne. Bergerak dari kiri ke kanan, kita menemukan jumlah elektron inti (1s²) tetap konstan sementara muatan inti meningkat. Namun, karena elektron yang ditambahkan adalah elektron valensi dan elektron valensi tidak saling melindungi dengan baik, efek bersih bergerak melintasi periode adalah muatan inti efektif yang lebih besar yang dirasakan oleh elektron valensi, seperti yang ditunjukkan di sini.
Muatan inti efektif juga meningkat ketika kita menurunkan golongan periodik tertentu. Namun, karena elektron valensi sekarang ditambahkan ke kulit yang semakin besar ketika n bertambah, tarikan elektrostatik antara inti dan elektron valensi sebenarnya berkurang.
Jari-Jari Atom
Sejumlah sifat fisik, termasuk kerapatan, titik lebur, dan titik didih, terkait dengan ukuran atom, tetapi ukuran atom sulit untuk didefinisikan. Seperti yang kita lihat di Bab 7, kerapatan elektron dalam atom jauh melampaui inti, tetapi kita biasanya menganggap ukuran atom sebagai volume yang mengandung sekitar 90 persen dari total kerapatan elektron di sekitar inti. Ketika kita harus lebih spesifik, kita mendefinisikan ukuran atom dalam hal jari-jari atomnya, yang merupakan setengah jarak antara dua inti dalam dua atom logam yang berdekatan atau dalam molekul diatomik.
Untuk atom-atom yang dihubungkan bersama membentuk jaringan tiga dimensi yang luas, jari-jari atom hanyalah setengah jarak antara inti dalam dua atom yang bertetangga [Gambar 8.4 (a)]. Untuk unsur-unsur yang ada sebagai molekul diatomik sederhana, jari-jari atom adalah setengah jarak antara inti dua atom dalam molekul tertentu [Gambar 8.4 (b)].
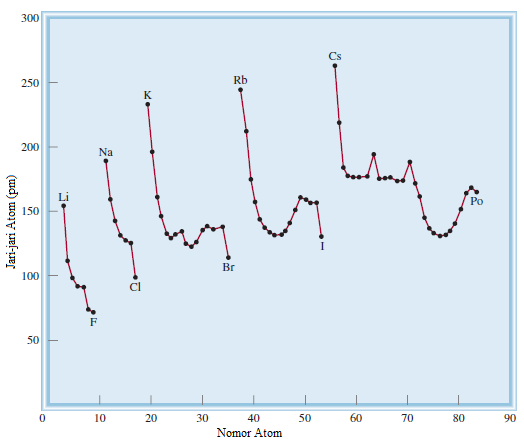
Gambar 8.5 menunjukkan jari-jari atom banyak unsur sesuai dengan posisinya dalam tabel periodik, dan Gambar 8.6 memplot jari-jari atom dari unsur-unsur ini terhadap nomor atomnya. Kecenderungan berkala jelas terlihat. Pertimbangkan unsur periode kedua. Karena muatan inti efektif meningkat dari kiri ke kanan, elektron valensi yang ditambahkan pada setiap langkah lebih kuat tertarik oleh inti daripada yang sebelumnya. Oleh karena itu, kita berharap dan memang menemukan jari-jari atom menurun dari Li ke Ne. Dalam sebuah golongan kita menemukan bahwa jari-jari atom bertambah dengan bertambah nomor atom. Untuk logam alkali di Golongan 1A, elektron valensi berada di orbital ns. Karena ukuran orbital meningkat dengan meningkatnya bilangan kuantum utama n, ukuran jari-jari atom meningkat walaupun muatan inti efektif juga meningkat dari Li ke Cs.
Gambar 8.5 Jari-jari atom (dalam pikometer) unsur-unsur yang representatif menurut posisi mereka dalam tabel periodik. Perhatikan bahwa tidak ada kesepakatan umum tentang ukuran jari-jari atom. Kita hanya fokus pada tren dalam jari-jari atom, bukan pada nilai tepatnya.
Contoh 8.2
Mengacu pada tabel periodik, atur atom-atom berikut menurut peningkatan jari-jari atom: P, Si, N.
Strategi
Apa kecenderungan dalam jari-jari atom dalam golongan periodik dan periode tertentu? Manakah dari unsur-unsur sebelumnya yang berada dalam golongan yang sama? dalam periode yang sama?
Penyelesaian
Dari Gambar 8.1 kita melihat bahwa N dan P berada dalam golongan yang sama (Golongan 5A). Oleh karena itu, jari-jari N lebih kecil dari jari-jari P (jari-jari atom bertambah ketika kita turun satu golongan). Baik Si dan P berada dalam periode ketiga, dan Si berada di sebelah kiri P. Oleh karena itu, jari-jari P lebih kecil dari Si (jari-jari atom berkurang ketika kita bergerak dari kiri ke kanan melintasi suatu periode). Dengan demikian, urutan peningkatan jari-jari ataom adalah N < P < Si.
Latihan
Aturlah atom-atom berikut dalam urutan menurut penurunan jari-jari: C, Li, Be.
Ulasan Konsep
Bandingkan ukuran masing-masing pasangan atom yang tercantum di sini: (a) Be, Ba; (b) Al, S; (c) ¹²C, ¹³C.
Jari-Jari Ion
Jari-jari ion adalah jari-jari kation atau anion. Itu dapat diukur dengan difraksi sinar-X (lihat Bab 11). Jari-jari ion mempengaruhi sifat fisik dan sifat kimia senyawa ionik. Misalnya, struktur tiga dimensi senyawa ionik tergantung pada ukuran relatif kation dan anionnya.
Ketika atom netral dikonversi menjadi ion, kita mengharapkan perubahan ukuran. Jika atom membentuk anion, ukurannya (atau jari-jari) meningkat, karena muatan inti tetap sama tetapi tolakan yang dihasilkan oleh elektron tambahan memperbesar domain dari awan elektron. Di sisi lain, mengeluarkan satu atau lebih elektron dari atom mengurangi tolakan elektron-elektron tetapi muatan inti tetap sama, sehingga awan elektron menyusut, dan kation lebih kecil dari atom. Gambar 8.7 menunjukkan perubahan ukuran yang dihasilkan ketika logam alkali dikonversi menjadi kation dan halogen dikonversi menjadi anion; Gambar 8.8 menunjukkan perubahan ukuran yang terjadi ketika atom litium bereaksi dengan atom fluor membentuk satuan LiF.
Gambar 8.7 Perbandingan jari-jari atom dengan jari-jari ion. (a) Logam alkali dan kation logam alkali. (b) Halogen dan ion halida.
Gambar 8.8 Perubahan ukuran Li dan F saat bereaksi membentuk LiF.
Gambar 8.9 menunjukkan jari-jari ion yang berasal dari unsur-unsur yang umum, disusun sesuai dengan posisi unsur-unsur dalam tabel periodik. Kita bisa melihat kecenderungan paralel antara jari-jari atom dan jari-jari ion. Misalnya, dari atas ke bawah, baik jari-jari atom maupun jari-jari ion meningkat dalam suatu golongan. Untuk ion yang berasal dari unsur-unsur dalam golongan yang berbeda, perbandingan ukuran hanya bermakna jika ion-ion tersebut adalah isoelektronik. Jika kita memeriksa ion isoelektronik, kita menemukan bahwa kation lebih kecil dari anion. Sebagai contoh, Na⁺ lebih kecil dari F⁻. Kedua ion memiliki jumlah elektron yang sama, tetapi Na (Z = 11) memiliki lebih banyak proton daripada F (Z = 9). Muatan inti efektif yang lebih besar menghasilkan Na⁺ dalam jari-jari yang lebih kecil.
Gambar 8.9 Jari-jari (dalam pikometer) dari ion unsur-unsur yang umum diatur sesuai dengan posisi unsur-unsur dalam tabel periodik.
Berfokus pada kation isoelektronik, kita melihat bahwa jari-jari ion tripositif (ion yang mengandung tiga muatan positif) lebih kecil daripada ion dipositif (ion yang mengandung dua muatan positif), yang pada gilirannya lebih kecil dari ion yang tidak positif (ion yang mengandung satu muatan positif). Kecenderungan ini diilustrasikan dengan baik oleh ukuran tiga ion isoelektronik pada periode ketiga: Al³⁺, Mg²⁺, dan Na⁺ (lihat Gambar 8.9). Ion Al³⁺ memiliki jumlah elektron yang sama dengan Mg²⁺, tetapi memiliki satu proton lagi. Jadi, awan elektron pada Al³⁺ ditarik ke dalam lebih dari pada Mg²⁺. Jari-jari Mg²⁺ yang lebih kecil dibandingkan dengan Na⁺ dapat dijelaskan dengan cara yang sama. Beralih ke anion isoelektronik, kita menemukan bahwa jari-jari meningkat ketika kita pergi dari ion dengan muatan uninegatif (-) ke yang dengan muatan dinegatif (2-), dan seterusnya. Dengan demikian, ion oksida lebih besar dari ion fluor karena oksigen memiliki satu proton lebih sedikit daripada ion fluor; awan elektron lebih tersebar di ion O²⁻.
Contoh 8.3
Untuk masing-masing pasangan berikut, tunjukkan yang mana dari dua spesies yang lebih besar: (a) N³⁻ atau F⁻; (B) Mg²⁺ atau Ca²⁺; (c) Fe²⁺ atau Fe³⁺
Strategi
Dalam membandingkan jari-jari ion, akan berguna untuk mengklasifikasikan ion ke dalam tiga kategori: (1) ion isoelektronik, (2) ion yang membawa muatan yang sama dan dihasilkan dari atom-atom dari golongan periodik yang sama, dan (3) ion membawa muatan yang berbeda tetapi dihasilkan dari atom yang sama. Dalam kasus (1), ion yang membawa muatan negatif lebih besar selalu lebih besar; dalam kasus (2), ion dari atom yang memiliki nomor atom lebih besar selalu lebih besar; dalam kasus (3), ion yang memiliki muatan positif lebih kecil selalu lebih besar.
Penyelesaian
(a) N³⁻ dan F⁻ adalah anion isoelektronik, keduanya mengandung 10 elektron. Karena N³⁻ hanya memiliki tujuh proton dan F⁻ memiliki sembilan, tarikan yang lebih kecil yang diberikan oleh inti pada elektron menghasilkan ion N³⁻ yang lebih besar.
(b) Baik Mg dan Ca anggota Golongan 2A (logam alkali tanah). Dengan demikian, ion Ca²⁺ lebih besar dari Mg²⁺ karena elektron valensi Ca berada dalam kulit yang lebih besar (n = 4) daripada Mg (n = 3).
(c) Kedua ion memiliki muatan inti yang sama, tetapi Fe²⁺ memiliki satu elektron lebih banyak (24 elektron dibandingkan dengan 23 elektron untuk Fe³⁺) dan karenanya tolakan elektron-elektron lebih besar. Jari-jari Fe²⁺ lebih besar.
(b) Baik Mg dan Ca anggota Golongan 2A (logam alkali tanah). Dengan demikian, ion Ca²⁺ lebih besar dari Mg²⁺ karena elektron valensi Ca berada dalam kulit yang lebih besar (n = 4) daripada Mg (n = 3).
(c) Kedua ion memiliki muatan inti yang sama, tetapi Fe²⁺ memiliki satu elektron lebih banyak (24 elektron dibandingkan dengan 23 elektron untuk Fe³⁺) dan karenanya tolakan elektron-elektron lebih besar. Jari-jari Fe²⁺ lebih besar.
Latihan
Pilih ion yang lebih kecil di masing-masing pasangan berikut: (a) K⁺, Li⁺; (b) Au⁺, Au³⁺; (c) P³⁻, N³⁻.
Ulasan Konsep
Identifikasi bola-bola yang ditunjukkan di sini dengan masing-masing bidang berikut: S²⁻, Mg²⁺, F⁻, Na⁺.
Variasi Sifat Fisik Dalam Periode dan Dalam Golongan
Dari kiri ke kanan melintasi periode ada transisi dari logam ke metaloid ke bukan logam. Pertimbangkan unsur periode ketiga dari natrium sampai argon (Gambar 8.10). Natrium, unsur pertama dalam periode ketiga, adalah logam yang sangat reaktif, sedangkan klorin, unsur kedua hingga terakhir dari periode itu, adalah bukan logam yang sangat reaktif. Di antaranya, unsur-unsur tersebut menunjukkan transisi bertahap dari sifat logam ke sifat non logam. Natrium, magnesium, dan aluminium semuanya memiliki jaringan atom tiga dimensi yang luas, yang disatukan oleh kekuatan karakteristik dari keadaan logam. Silikon adalah metaloid; yang memiliki struktur tiga dimensi raksasa di mana atom-atom Si disatukan sangat kuat. Dimulai dengan fosfor, unsur-unsurnya ada dalam satuan molekul sederhana, diskrit (P₄, S₈, Cl₂, dan Ar) yang memiliki titik leleh dan titik didih rendah.
Gambar 8.10 Unsur periode ketiga. Foto argon, yang merupakan gas yang tidak berwarna dan tidak berbau, menunjukkan warna yang dipancarkan oleh gas dari tabung pelepasan.
Dalam golongan periodik sifat fisik bervariasi lebih dapat diprediksi, terutama jika unsur-unsurnya berada dalam keadaan fisik yang sama. Misalnya, titik lebur argon dan xenon masing-masing adalah -189,2°C dan -111,9°C. Kita dapat memperkirakan titik lebur kripton unsur yang berada diantara keduanya dengan mengambil rata-rata dari kedua nilai ini sebagai berikut:
Nilai ini cukup dekat dengan titik leleh sebenarnya -156,6°C.










No comments:
Post a Comment
Note: Only a member of this blog may post a comment.