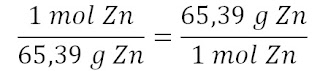Satuan massa atom menyediakan skala massa atom relatif untuk berbagai unsur. Tetapi karena atom memiliki massa yang sangat kecil, sehingga tidak ada skala yang dapat digunakan untuk menimbang atom dalam satuan massa atom yang dikalibrasi. Dalam situasi sebenarnya, kita berurusan dengan sampel makroskopik yang mengandung sejumlah besar atom. Oleh karena itu, akan lebih mudah apabila kita memiliki satuan khusus untuk menggambarkan sejumlah besar atom. Gagasan satuan untuk menunjukkan sejumlah zat tertentu bukanlah hal baru. Misalnya, sepasang (2 buah), selusin (12 buah), dan gros (144 buah) semuanya adalah satuan yang umum. Para ahli kimia sepakat mengukur jumlah atom dan molekul dalam satuan mol.
Dalam sistem SI, mol adalah jumlah zat yang mengandung banyaknya entitas dasar (atom, molekul, atau partikel lain) sebanyak jumlah atom yang terdapat dalam tepat 12 g (atau 0,012 kg) dari isotop karbon-12. Jumlah aktual atom dalam 12 g karbon-12 ditentukan secara eksperimental. Bilangan ini disebut bilangan Avogadro (NA), untuk menghormati ilmuwan Italia Amedeo Avogadro. Nilai yang diterima saat ini adalah:
NA = 6,0221367 x 10²³
Secara umum, kita membulatkan bilangan Avogadro menjadi 6,022 x 10²³. Jadi, sama seperti satu lusin jeruk mengandung 12 jeruk, 1 mol atom hidrogen (H) mengandung 6,022 x 10²³ atom H. Gambar 3.1 menunjukkan sampel yang mengandung 1 mol masing-masing dari beberapa unsur yang sering dijumpai.
Gambar 3.1 Satu mol masing-masing dari beberapa unsur umum. Karbon (serbuk arang hitam), belerang (bubuk kuning), besi (bentuk paku), kawat tembaga, dan merkuri (logam cair mengkilap).
Besarnya bilangan Avogadro sulit dibayangkan. Misalnya, Jika kita menyebarkan 6,022 x 10²³ buah jeruk di seluruh permukaan Bumi maka akan dihasilkan lapisan setinggi 14,48 km (9 mil) sampai ke angkasa! Karena atom (dan molekul) sangat kecil, kita membutuhkan sejumlah besar atom untuk mempelajarinya dalam jumlah yang dapat diukur dan diamati.
Kita telah mengetahui bahwa 1 mol atom karbon-12 memiliki massa tepat 12 g dan mengandung 6,022 x 10²³ atom. Massa karbon-12 ini adalah massa molar (M), didefinisikan sebagai massa (dalam gram atau kilogram) dari 1 mol entitas (seperti atom atau molekul) dari suatu zat. Perhatikan bahwa massa molar karbon-12 (dalam gram) secara numerik sama dengan massa atomnya dalam sma. Demikian juga, massa atom natrium (Na) adalah 22,99 sma dan massa molarnya adalah 22,99 g; massa atom fosfor adalah 30,97 sma dan massa molarnya adalah 30,97 g; dan seterusnya. Jika kita mengetahui massa atom suatu unsur, maka kita juga mengetahui massa molarnya.
Jika diketahui massa molar dan bilangan Avogadro, maka kita dapat menghitung massa satu atom dalam gram. Sebagai contoh, kita tahu massa molar karbon-12 adalah 12,00 g dan terdapat 6,022 x 10²³ atom karbon-12 dalam 1 mol zat; oleh karena itu, massa satu atom karbon-12 dapat dihitung dengan persamaan:
Kita dapat menggunakan hasil ini untuk menentukan hubungan antara satuan massa atom dan gram. Karena massa setiap atom karbon-12 adalah tepat 12 sma, jumlah satuan massa atom yang setara dengan 1 gram adalah
= 6,022 x 10²³ sma/g
Jadi,
1 gram karbon-12 = 6,022 x 10²³ sma karbon-12
dan
1 sma karbon-12 = 1,661 x 10⁻²⁴ g karbon-12
Contoh ini menunjukkan bahwa bilangan Avogadro dapat digunakan untuk mengonversi dari satuan massa atom ke massa dalam gram dan sebaliknya.
Pengertian bilangan Avogadro dan massa molar memungkinkan kita untuk melakukan konversi antara massa atom dan mol dan antara mol dan jumlah atom (Gambar 3.2). Kita akan menggunakan faktor konversi berikut dalam perhitungan:
di mana X mewakili simbol suatu unsur. Dengan menggunakan faktor konversi yang tepat, kita dapat mengonversi suatu kuantitas ke kuantitas lainnya, seperti Contoh 3.2–3.4.
Gambar 3.2 Hubungan antara massa (m dalam gram) dari suatu unsur dengan jumlah mol suatu unsur (n) dan antara jumlah mol suatu unsur dengan jumlah atom (N) dari suatu unsur. M adalah massa molar (g/mol) dari unsur dan NA adalah bilangan Avogadro.
Contoh 3.2
Helium (He) adalah gas mulia yang digunakan dalam industri, penelitian suhu rendah, tangki penyelaman laut dalam dan balon udara. Berapa jumlah mol atom He dalam 6,46 g He?
Strategi
Diketahui gram helium dan ditanyakan mol helium. Faktor konversi apa yang kita perlukan untuk mengkonversi antara gram dan mol? Atur faktor konversi yang sesuai sehingga satuan gram dihilangkan dan mol satuan yang diperoleh untuk jawaban yang diminta.
Penyelesaian
Faktor konversi yang diperlukan untuk mengonversi antara gram dan mol adalah massa molar. Dalam tabel periodik (lihat tabel) diketahui bahwa massa molar He adalah 4,003 g. Ini bisa dinyatakan sebagai berikut
1 mol He = 4,003 g He
Berdasarkan persamaan ini, kita dapat menuliskan dua faktor konversi
Faktor konversi di sebelah kiri adalah yang benar. Gram akan dihilangkan, menyisakan satuan mol untuk jawaban yang diminta, yaitu,
Jadi, dalam 6,46 g He terdapat 1,61 mol He.
Periksa
Karena massa yang diketahui (6,46 g) lebih besar dari massa molar He, maka harus diperoleh jumlah He lebih dari 1 mol.
Latihan
Berapa banyak mol magnesium (Mg) yang ada dalam 87,3 g Mg?
Contoh 3.3
Seng (Zn) adalah logam berwarna perak yang digunakan untuk membuat kuningan (bersama tembaga) dan melapisi besi untuk mencegah korosi. Berapa gram massa Zn dalam 0,356 mol Zn?
Strategi
Ditanyakan jumlah gram seng. Faktor konversi apa yang perlu kita ubah antara mol dan gram? Atur faktor konversi yang sesuai agar satuan mol dihilangkan dan satuan gram diperoleh untuk jawaban yang diminta.
Penyelesaian
Faktor konversi yang diperlukan untuk mengkonversi antara mol dan gram adalah massa molar. Dalam tabel periodik (lihat tabel) diketahui massa molar dari Zn adalah 65,39 g. Ini bisa dinyatakan sebagai
1 mol Zn = 65,39 g Zn
Berdasarkan persamaan ini, kita dapat menuliskan dua faktor konversi
Faktor konversi di sebelah kanan adalah yang benar. Mol akan dihilangkan, menyisakan satuan gram untuk jawaban yang diminta, yaitu,
Jadi, dalam 0,356 mol Zn terdapat 23,3 g Zn.
Periksa
Apakah massa 23,3 g untuk 0,356 mol Zn tampaknya masuk akal? Berapa massa 1 mol Zn?
Latihan
Hitung jumlah gram timbal (Pb) dalam 12,4 mol timbal.
Contoh 3.4
Belerang (S) adalah unsur non logam. Adanya sulfur dalam batubara mengakibatkan fenomena terjadinya hujan asam. Berapakah jumlah atom yang ada di dalam 16,3 g S?
Strategi
Pertanyaannya meminta jumlah atom sulfur. Kita tidak dapat mengkonversi langsung dari gram ke jumlah atom sulfur. Satuan apa yang kita perlukan untuk mengubah gram belerang menjadi jumlah atom? Apa yang ditunjukkan oleh bilangan Avogadro?
Penyelesaian
Kita membutuhkan dua faktor konversi: pertama dari gram ke mol dan kemudian dari mol ke jumlah partikel (atom). Langkah pertama mirip dengan Contoh 3.2. Karena
1 mol S = 32,07 g S
Bilangan Avogadro adalah kunci untuk langkah kedua. Kita memiliki
1 mol = 6,022 x 10²³ partikel (atom)
faktor konversinya adalah
Faktor konversi di sebelah kiri adalah yang kita gunakan karena memiliki jumlah atom S dalam pembilang. Kita dapat memecahkan masalah dengan menghitung jumlah mol dahulu yang terkandung dalam 16,3 g S, dan kemudian menghitung jumlah atom S dari jumlah mol S:
gram S → mol S → Jumlah atom S
Kita dapat menggabungkan konversi ini dalam satu langkah sebagai berikut:
Jadi, dalam 16,3 g S terdapat 3,06 x 10²³ atom S
Periksa
Haruskah 16,3 g S mengandung atom lebih sedikit dari bilangan Avogadro? Berapa massa gram S yang mengandung atom sebanyak bilangan Avogadro?
Latihan
Hitung jumlah atom dalam 0,551 g kalium (K).