Hukum-hukum, prinsip-prinsip dan konsep-konsep dasar yang perlu dipelajari oleh siswa dan mahasiswa untuk menjelajah ilmu kimia. (Sebagian besar Topik Diterjemahkan dari Buku Chemistry 10th Edition Raymond Chang Tahun 2010).
Thursday, June 21, 2018
Tugas 2
1. Belajarlah sebelum mengerjakan Tugas 2!
2. Berdoa dan Bekerjalah!
3. Kerjakan Tugas Secara Mandiri.
4. Waktu 1 minggu sejak dibuka
5. Tugas dikerjakan sejak dibuka (mulai jam 07.00 hari ke 1- 21.00 hari ke-7).
6. Kerjakan masing-masing dan dilarang bekerja sama.
7. Kerjakan pada kertas (jika tulis tangan) atau word/sejenisnya (jika diketik). Kirim foto/scan atau file ke WA 085229765655 atau email ke nopriawanb@gmail.com
8. Jangan Lupa Tulis Nama dan NIM!
Tugas 2
2. Berdoa dan Bekerjalah!
3. Kerjakan Tugas Secara Mandiri.
4. Waktu 1 minggu sejak dibuka
5. Tugas dikerjakan sejak dibuka (mulai jam 07.00 hari ke 1- 21.00 hari ke-7).
6. Kerjakan masing-masing dan dilarang bekerja sama.
7. Kerjakan pada kertas (jika tulis tangan) atau word/sejenisnya (jika diketik). Kirim foto/scan atau file ke WA 085229765655 atau email ke nopriawanb@gmail.com
8. Jangan Lupa Tulis Nama dan NIM!
Tugas 2
- Diameter atom helium adalah sekitar 1 x 102 pm. Misalkan kita bisa menyejajarkan atom helium bersambungan satu sama lain. Kira-kira berapa banyak atom yang diperlukan untuk membuat jarak dari ujung ke ujung sepanjang 1 cm?
- Secara kasar, jari-jari atom sekitar 10.000 kali lebih besar daripada intinya. Jika sebuah atom diperbesar sehingga jari-jari intinya menjadi 2,0 cm, seukuran kelereng, berapakah jari-jari atom dalam mil? (1 mil = 1609 m.)
- Berapa jumlah massa atom besi yang memiliki 28 neutron?
- Hitung jumlah neutron 239Pu.
- Untuk masing-masing spesies berikut, tentukan jumlah proton dan jumlah neutron dalam nukleus: 32He, 42He, 2412Mg, 2512Mg, 4822Ti, 7935Br, 19578Pt
- Indikasikan jumlah proton, neutron, dan elektron pada masing-masing spesies berikut: 157N, 3316S, 6329Cu, 8438Sr, 13056Ba, 18674W, 20280Hg
- Tulis simbol yang sesuai untuk masing-masing isotop berikut: (a) Z = 11, A = 23; (b) Z = 28, A = 64.
- Tuliskan simbol yang sesuai untuk masing-masing isotop berikut: (a) Z = 74, A = 186; (b) Z = 80; A = 201.
- Unsur yang namanya diakhiri dengan -ium biasanya adalah logam; natrium adalah salah satu contoh. Identifikasi nonlogam yang namanya juga berakhir dengan -ium.
- Jelaskan perubahan dalam sifat (dari logam ke nonlogam atau dari bukan logam menjadi logam) saat kita bergerak (a) ke bawah dalam satu golongan dan (b) dari kiri ke kanan dalam satu periode.
- Konsultasikan buku pegangan data kimia dan fisika (tanyakan kepada dosen Anda di mana Anda dapat menemukan salinan buku pegangan) untuk menemukan (a) dua logam yang kurang padat daripada air, (b) dua logam yang lebih padat daripada merkuri, (c) unsur logam padat terpadat yang diketahui, (d) unsur non-logam padat terpadat yang diketahui.
- Kelompokkan unsur-unsur berikut secara berpasangan yang Anda harapkan untuk menunjukkan sifat kimia yang serupa: K, F, P, Na, Cl, dan N.
- Manakah dari diagram berikut yang merepresentasi molekul diatomik, molekul poliatomik, molekul yang bukan senyawa, molekul yang merupakan senyawa, atau unsur membentuk senyawa?
- Manakah dari diagram berikut yang merepresentasi molekul diatomik, molekul poliatomik, molekul yang bukan senyawa, molekul yang merupakan senyawa, atau unsur membentuk senyawa?
- Identifikasikan yang berikut ini sebagai unsur atau senyawa: NH3, N2, S8, NO, CO, CO2, H2, SO2.
- Berikan dua contoh dari masing-masing pernyataan berikut: (a) suatu molekul diatomik yang mengandung atom-atom dari unsur yang sama, (b) suatu molekul diatomik yang mengandung atom-atom dari unsur-unsur yang berbeda, (c) suatu molekul poliatomik yang mengandung atom-atom dari unsur yang sama, (d) suatu molekul poliatomik yang mengandung atom dari berbagai unsur.
- Berikan jumlah proton dan elektron pada masing-masing ion berikut: Na+, Ca2+, Al3+, Fe2+, I-, F-, S2-, O2-, dan N3-.
- Berikan jumlah proton dan elektron pada masing-masing ion berikut: K+, Mg2+, Fe3+, Br-, Mn2+, C4-, Cu2+
- Tuliskan rumus untuk senyawa ionik berikut: (a) natrium oksida, (b) sulfida besi (mengandung ion Fe2+), (c) kobalt sulfat (mengandung ion Co3+ dan SO42-), dan (d) barium fluorida. (Petunjuk: Lihat Gambar 2.11.)
- Tuliskan rumus untuk senyawa ionik berikut: (a) tembaga bromida (mengandung ion Cu+), (b) oksida mangan (mengandung ion Mn3+), (c) merkuri iodida (mengandung ion Hg22+), dan (d) ) magnesium fosfat (mengandung ion PO43+). (Petunjuk: Lihat Gambar 2.11.)
- Apa rumus empiris dari senyawa-senyawa berikut? (a) C2N2, (b) C6H6, (c)C9H20, (d) P4O10, (e) B2H6
- Apa rumus empiris dari senyawa-senyawa berikut? (a) Al2Br6, (b) Na2S2O4, (c) N2O5, (d) K2Cr2O7
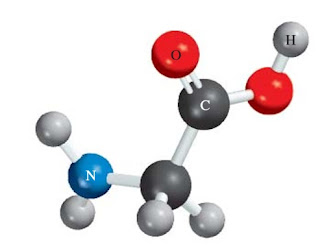
- Tuliskan rumus molekul glisin, asam amino yang ada dalam protein. Kode warna adalah: hitam (karbon), biru (nitrogen), merah (oksigen), dan abu-abu (hidrogen).
- Tuliskan rumus molekul etanol. Kode warna: hitam (karbon), merah (oksigen), dan abu-abu (hidrogen).
- Manakah dari senyawa berikut yang cenderung menjadi ion? Yang mungkin molekul? SiCl4, LiF, BaCl2, B2H6, KCl, C2H4
- Manakah dari senyawa berikut yang cenderung menjadi ion? Yang mungkin molekul? CH4, NaBr, BaF2, CCl4, ICl, CsCl, NF3
- Sebutkan senyawa-senyawa ini: (a) Na2CrO4, (b) K2HPO4, (c) HBr (gas), (d) HBr (dalam air), (e) Li2CO3, (f) K2Cr2O7, (g) NH4NO2, (h) PF3, (i) PF5, (j) P4O6, (k) CdI2, (l) SrSO4, (m) Al(OH)3, (n) Na2CO3.10H2O.
- Sebutkan senyawa-senyawa ini: (a) KClO, (b) Ag2CO3, (c) FeCl2, (d) KMnO4, (e) CsClO3, (f) HIO, (g) FeO, (h) Fe2O3, (i) TiCl4, (j) NaH, (k) Li3N, (l) Na2O, (m) Na2O2, (n) FeCl3.6H2O
- Tuliskan rumus untuk senyawa-senyawa berikut: (a) rubidium nitrit, (b) kalium sulfida, (c) natrium hidrogen sulfida, (d) magnesium fosfat, (e) kalsium hidrogen fosfat, (f) kalium dihidrogen fosfat, ( g) iodin heptafluorida, (h) amonium sulfat, (i) perklorat perak, (j) boron triklorida.
- Tuliskan rumus untuk senyawa-senyawa berikut: (a) tembaga (I) sianida, (b) strontium klorit, (c) asam perbromat, (d) asam hidroiodat, (e) dinatrium amonium fosfat, (f) timbal (II) karbonat, (g) timah (II) fluorida, (h) tetrafosfor dekasulfida, (i) merkuri (II) oksida, (j) merkuri (I) iodida, (k) selenium heksafluorida.
Ringkasan Pengetahuan Faktual dan Konseptual 2

- Kimia modern dimulai dengan teori atom Dalton, yang menyatakan bahwa semua materi tersusun atas partikel-partikel kecil yang tak terpisahkan yang disebut atom; bahwa semua atom dari unsur yang sama itu identik; Senyawa-senyawa itu mengandung atom-atom unsur-unsur yang berbeda yang digabungkan dalam rasio bilangan bulat; dan bahwa atom tidak diciptakan atau dihancurkan dalam reaksi kimia (hukum kekekalan massa).
- Atom unsur penyusun dalam senyawa tertentu selalu dikombinasikan dalam proporsi yang sama dengan massa (hukum proporsi tetap). Ketika dua unsur dapat bergabung untuk membentuk lebih dari satu jenis senyawa, massa dari satu unsur yang bergabung dengan massa tetap dari unsur lainnya berada dalam rasio bilangan bulat sederhana (hukum proporsi ganda).
- Sebuah atom terdiri dari inti pusat yang sangat padat yang mengandung proton dan neutron, dengan elektron bergerak di sekitar inti pada jarak yang relatif besar darinya.
- Proton bermuatan positif, neutron tidak memiliki muatan, dan elektron bermuatan negatif. Proton dan neutron memiliki massa yang kira-kira sama, yaitu sekitar 1.840 kali lebih besar dari massa elektron.
- Nomor atom unsur adalah jumlah proton dalam inti atom dari unsur; nomor atom menentukan identitas suatu unsur. Nomor massa adalah jumlah proton dan jumlah neutron dalam inti.
- Isotop adalah atom dari unsur yang sama dengan jumlah proton yang sama tetapi jumlah neutron yang berbeda.
- Rumus kimia menggabungkan simbol-simbol unsur-unsur penyusun dengan subskrip angka keseluruhan untuk menunjukkan jenis dan jumlah atom yang terkandung dalam unit terkecil suatu senyawa.
- Rumus molekul menyampaikan nomor spesifik dan jenis atom yang digabungkan dalam setiap molekul senyawa. Rumus empiris menunjukkan rasio paling sederhana dari atom yang digabungkan dalam sebuah molekul.
- Senyawa kimia adalah senyawa molekul (di mana unit terkecil bersifat diskrit, molekul individual) atau senyawa ionik, yang terbentuk dari kation dan anion.
- Nama-nama dari banyak senyawa anorganik dapat disimpulkan dari seperangkat aturan sederhana. Rumus dapat ditulis dari nama-nama senyawa.
- Senyawa organik mengandung karbon dan unsur-unsur seperti hidrogen, oksigen, dan nitrogen. Hidrokarbon adalah jenis senyawa organik yang paling sederhana
Latihan 2
Ulasan Konsep 2
Struktur Atom (1-6)
Nomor Atom, Massa Atom dan Isotop (7-10)
Tabel Periodik (11-14)
Molekul dan Ion (15-18)
Rumus Kimia (19-24)
Tatanama Senyawa Anorganik (25-30)
- Definisikan istilah berikut: (a) partikel α, (b) partikel β, (c) sinar γ, (d) sinar X.
- Sebutkan jenis-jenis radiasi yang diketahui dipancarkan oleh unsur-unsur radioaktif.
- Bandingkan sifat-sifat berikut: sinar katoda, proton, neutron, elektron.
- Apa yang dimaksud dengan istilah “partikel dasar”?
- Jelaskan kontribusi para ilmuwan berikut terhadap pengetahuan tentang struktur atom: J. J. Thomson, R. A. Millikan, Ernest Rutherford, James Chadwick.
- Jelaskan dasar eksperimental untuk mempercayai bahwa inti atom menempati sebagian kecil dari volume atom.
- Gunakan isotop helium-4 untuk mendefinisikan nomor atom dan nomor massa. Mengapa pengetahuan nomor atom memungkinkan untuk menyimpulkan jumlah elektron yang ada dalam atom?
- Mengapa semua atom unsur tertentu memiliki nomor atom yang sama, meskipun mereka mungkin memiliki bilangan massa yang berbeda?
- Apa sebutan untuk atom dari unsur yang sama dengan bilangan massa yang berbeda?
- Jelaskan arti setiap simbol dalam lambang unsur:

- Apakah tabel periodik itu dan apa maknanya dalam pelajaran kimia?
- Sebutkan dua perbedaan antara unsur logam dan non logam!
- Tuliskan nama dan simbol untuk empat unsur di masing-masing kategori berikut: (a) non logam, (b) logam, (c) metaloid.
- Definisikan dan beri dua contoh, istilah berikut: (a) logam alkali, (b) logam alkali tanah, (c) halogen, (d) gas mulia.
- Apa perbedaan antara atom dan molekul?
- Apa yang dimaksud dengan alotrop? Berikan contohnya. Bagaimana alotrop berbeda dari isotop?
- Jelaskan dua model molekul yang umum digunakan!
- Berikan sebuah contoh dari masing-masing jenis berikut: (a) kation monoatomik, (b) anion monoatomik, (c) kation poliatomik, (d) anion poliatomik.
- Apa yang ditunjukkan oleh rumus kimia? Berapa rasio atom dalam rumus molekul berikut? (a) NO, (b) NCl₃, (c) N₂O₄, (d) P₄O₆
- Definisikan rumus molekul dan rumus empiris. Apa persamaan dan perbedaan antara rumus empiris dan rumus molekul senyawa?
- Berikan contoh kasus di mana dua molekul memiliki rumus molekul yang berbeda tetapi rumus empiris yang sama!
- Apa arti P4? Apa bedanya dengan 4P?
- Apakah yang disebut senyawa ionik? Bagaimana netralitas listrik dipertahankan dalam senyawa ionik?
- Jelaskan mengapa rumus kimia senyawa ionik biasanya sama dengan rumus empirisnya!
- Apa perbedaan antara senyawa anorganik dan senyawa organik?
- Apa sajakah empat kategori utama senyawa anorganik?
- Berikan contoh masing-masing untuk senyawa biner dan senyawa terner.
- Apakah yang dimaksud dengan sistem Stock? Apa kelebihannya dibandingkan dengan sistem penamaan yang lebih tua?
- Jelaskan mengapa rumus HCl dapat mewakili dua sistem kimia yang berbeda.
- Jelaskan istilah-istilah berikut: asam, basa, asam okso, anion okso, dan hidrat.
.
Subscribe to:
Posts (Atom)