Hukum gas yang akan kita pelajari dalam bab ini adalah hasil eksperimen yang tak terhitung jumlahnya pada sifat fisika gas yang dilakukan selama beberapa abad. Masing-masing generalisasi mengenai perilaku makroskopis zat berwujud gas mewakili tonggak sejarah ilmu pengetahuan. Bersama-sama mereka telah memainkan peran utama dalam pengembangan banyak ide dalam kimia.
Hubungan Tekanan-Volume: Hukum Boyle
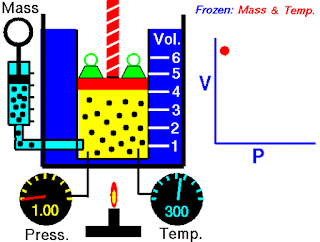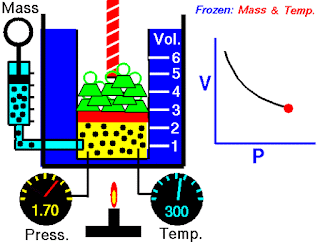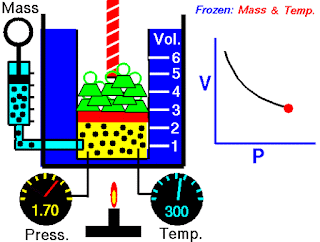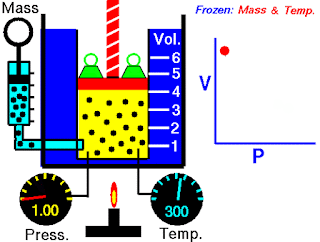
Pada abad ketujuh belas, Robert Boyle mempelajari perilaku gas secara sistematis dan kuantitatif. Dalam satu seri studi, Boyle menyelidiki hubungan tekanan-volume dari sampel gas. Data yang dikumpulkan oleh Boyle ditunjukkan pada Tabel 5.2. Perhatikan bahwa ketika tekanan (P) meningkat pada suhu tetap, volume (V) yang ditempati oleh jumlah gas tertentu berkurang. Bandingkan titik data pertama dengan tekanan 724 mmHg dan volume 1,50 (dalam satuan yang diinginkan) ke titik data terakhir dengan tekanan 2.250 mmHg dan volume 0,58. Jelas ada hubungan terbalik antara tekanan dan volume gas pada suhu tetap. Ketika tekanan meningkat, volume yang ditempati oleh gas berkurang. Sebaliknya, jika tekanan yang diberikan berkurang, volume yang ditempati gas meningkat. Hubungan ini sekarang dikenal sebagai hukum Boyle, yang menyatakan bahwa tekanan dari sejumlah tetap suatu gas pada suhu tetap berbanding terbalik dengan volume gas.
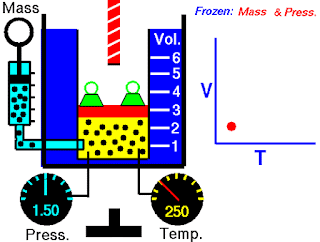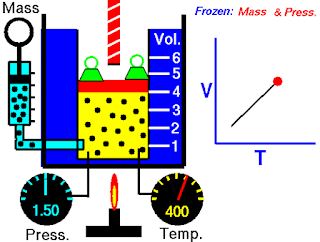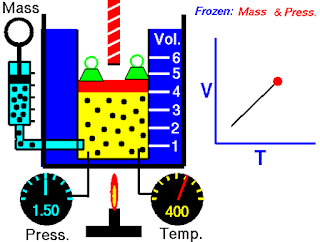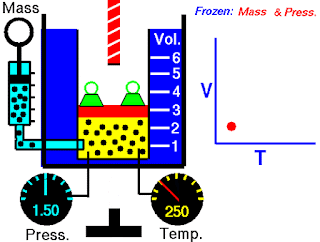
Peralatan yang digunakan oleh Boyle dalam percobaan ini sangat sederhana (Gambar 5.5). Pada Gambar 5.5 (a), tekanan yang diberikan pada gas sama dengan tekanan atmosfer dan volume gas adalah 100 mL. (Perhatikan bahwa tabung terbuka di bagian atas dan karena itu dikenai tekanan atmosfer.) Pada Gambar 5.5 (b), lebih banyak merkuri telah ditambahkan untuk menggandakan tekanan pada gas, dan volume gas berkurang hingga 50 mL. Tiga kali lipat tekanan pada gas bertambah volumenya berkurang hingga sepertiga dari nilai awalnya [Gambar 5.5 (c)].
Gambar 5.5 Peralatan untuk mempelajari hubungan antara tekanan dan volume gas. (a) Kadar merkuri tetap dan tekanan gas sama dengan tekanan atmosfer (760 mmHg). Volume gas adalah 100 mL. (b) Menggandakan tekanan dengan menambahkan lebih banyak merkuri mengurangi volume gas hingga 50 mL. (c) Tekanan tiga kali lipat menurunkan volume gas hingga sepertiga dari nilai awalnya. Suhu dan jumlah gas dijaga tetap.
Dapat ditulis persamaan matematika yang menunjukkan hubungan terbalik antara tekanan dan volume:
di mana simbol ∝ berarti sebanding dengan. Dapat diubah ∝ menjadi tanda sama dengan dan menulis
di mana k₁ adalah konstanta yang disebut konstanta proporsionalitas. Persamaan (5.1a) adalah ekspresi matematis dari hukum Boyle. Dapat diatur ulang Persamaan (5.1a) dan diperoleh
PV = k₁ (5.1b)
Bentuk hukum Boyle ini menyatakan bahwa hasilkali dari tekanan dan volume gas pada suhu dan jumlah gas tetap adalah tetap. Gambar teratas pada Gambar 5.6 adalah representasi skematis dari hukum Boyle. Kuantitas n adalah jumlah mol gas dan R adalah konstanta yang harus didefinisikan dalam Bagian 5.4. Kita akan mempelajari di Bagian 5.4 bahwa konstanta proporsionalitas k₁ dalam Persamaan (5.1b) sama dengan nRT.
Konsep satu besaran yang proporsional dengan besaran yang lain dan penggunaan konstanta proporsionalitas dapat diklarifikasi melalui analogi berikut. Penghasilan harian bioskop XXI tergantung pada harga tiket (dalam rupiah per tiket) dan jumlah tiket yang terjual. Dengan asumsi bahwa bioskop membebankan satu harga untuk semua tiket, dapat ditulis
pendapatan = (rupiah/tiket) x jumlah tiket terjual
Karena jumlah tiket yang dijual bervariasi dari hari ke hari, pendapatan pada hari tertentu dikatakan sebanding dengan jumlah tiket yang terjual:
pendapatan ∝ jumlah tiket terjual
= C x jumlah tiket terjual
di mana C, konstanta proporsionalitas, adalah harga per tiket.
Gambar 5.6 Ilustrasi skematis tentang hukum Boyle, hukum Charles, dan hukum Avogadro.
Gambar 5.7 menunjukkan dua cara konvensional untuk mengekspresikan temuan Boyle secara grafis. Gambar 5.7 (a) adalah grafik dari persamaan PV = k₁; Gambar 5.7 (b) adalah grafik persamaan ekuivalen P = k₁ x 1/V. Perhatikan bahwa yang terakhir adalah persamaan linier dari bentuk y = mx + b, di mana b = 0 dan m = k₁.
Gambar 5.7 Grafik yang menunjukkan variasi volume gas dengan tekanan yang diberikan pada gas, pada suhu tetap. (a) P terhadap V. Perhatikan bahwa volume gas bertambah dua kali lipat saat tekanannya dikurangi setengahnya. (b) P terhadap 1/V. Kemiringan garis sama dengan k₁.
Meskipun nilai dari masing-masing tekanan dan volume dapat sangat bervariasi untuk sampel gas tertentu, selama suhu tetap konstan dan jumlah gas tidak berubah, P kali V selalu sama dengan konstanta yang sama. Oleh karena itu, untuk sampel gas tertentu di bawah dua set keadaan yang berbeda pada suhu tetap, diperoleh
P₁V₁ = k₁ = P₂V₂
atau
P₁V₁ = P₂V₂
di mana V₁ dan V₂ adalah volume masing-masing pada tekanan P₁ dan P₂.
Hubungan Suhu-Volume: Hukum Charles dan Gay-Lussac
Hukum Boyle tergantung pada suhu sistem yang tetap. Tetapi misalkan suhu berubah: Bagaimana perubahan suhu mempengaruhi volume dan tekanan gas? Untuk melihat pengaruh suhu pada volume gas, Peneliti paling awal dari hubungan ini adalah ilmuwan Prancis, Jacques Charles dan Joseph Gay-Lussac. Penelitiannya menunjukkan bahwa, pada tekanan tetap, volume sampel gas mengembang ketika dipanaskan dan menyusut saat didinginkan (Gambar 5.8). Hubungan kuantitatif yang terlibat dalam perubahan suhu dan volume gas ternyata sangat konsisten. Sebagai contoh, dapat diamati sebuah fenomena menarik ketika mempelajari hubungan suhu-volume pada berbagai tekanan. Pada tekanan berapa pun, plot volume terhadap suhu menghasilkan garis lurus. Dengan memperpanjang garis ke volume nol, ditemukan perpotongan pada sumbu suhu dengan nilai -273,15ºC. Pada tekanan lain, diperoleh garis lurus yang berbeda dari plot antara suhu-volume, tetapi didapatkan perpotongan suhu pada volume nol yang sama, yaitu pada -273,15ºC (Gambar 5.9). (Dalam praktiknya, dapat diukur volume gas hanya pada kisaran suhu terbatas, karena semua gas mengembun pada suhu rendah membentuk cairan.)
Pada tahun 1848 Lord Kelvin menyadari arti penting dari fenomena ini. Ia mengidentifikasi -273,15ºC sebagai nol mutlak, secara teoritis suhu terendah yang dapat dicapai. Kemudian dia mengatur skala suhu mutlak, yang sekarang disebut skala suhu Kelvin, dengan nol mutlak sebagai titik awal. (lihat Bagian 1.7). Pada skala Kelvin, satu kelvin (K) besarnya sama dengan satu derajat Celcius. Satu-satunya perbedaan antara skala suhu mutlak dan skala Celcius adalah bahwa posisi nol digeser. Poin-poin penting pada dua skala disusun sebagai berikut:
Skala Kelvin Celsius
Nol mutlak 0 K -273,15ºC
Titik beku air 273,15 K 0ºC
Titik didih air 373,15 K 100ºC
Konversi antara ºC dan K diberikan. Dalam sebagian besar perhitungan akan digunakan 273 bukannya 273,15 sebagai istilah yang berhubungan dengan K dan ºC. Dengan perjanjian, digunakan T untuk menunjukkan suhu mutlak (Kelvin) dan t untuk menunjukkan suhu pada skala Celcius.
Ketergantungan volume gas pada suhu diberikan oleh
di mana k₂ adalah konstanta proporsionalitas. Persamaan (5.3) dikenal sebagai hukum Charles dan Gay-Lussac, atau hanya hukum Charles, yang menyatakan bahwa volume sejumlah tetap gas yang dipertahankan pada tekanan tetap berbanding lurus dengan suhu mutlak gas. Hukum Charles juga diilustrasikan pada Gambar 5.6. Dapat dilihat bahwa konstanta proporsionalitas k₂ dalam Persamaan (5.3) sama dengan nR/P.
Seperti yang dilakukan untuk hubungan tekanan-volume pada suhu tetap, dapat dibandingkan dua set keadaan volume-suhu untuk sampel gas tertentu pada tekanan tetap. Dari Persamaan (5.3) dapat ditulis
di mana V₁ dan V₂ adalah volume masing-masing gas pada suhu T₁ dan T₂ (keduanya dalam Kelvin).
Bentuk lain dari hukum Charles menunjukkan bahwa pada jumlah gas dan volume tetap, tekanan gas sebanding dengan suhu
Dari Gambar 5.6 dapat dilihat bahwa k₃ = nR/V. Dimulai dengan Persamaan (5.5), diperoleh
atau
di mana P₁ dan P₂ adalah tekanan gas masing-masing pada suhu T₁ dan T₂.
Hubungan Volume-Jumlah Mol: Hukum Avogadro
Karya ilmuwan Italia Amedeo Avogadro melengkapi studi tentang Boyle, Charles, dan Gay-Lussac. Pada tahun 1811 ia menerbitkan hipotesis yang menyatakan bahwa pada suhu dan tekanan yang sama, volume gas yang sama memiliki jumlah molekul yang sama (atau atom jika gasnya monatomik). Oleh karena itu, volume gas apa pun yang diberikan harus sebanding dengan jumlah mol molekul yang ada; itu adalah,
di mana n mewakili jumlah mol dan k₄ adalah konstanta proporsionalitas. Persamaan (5.7) adalah ekspresi matematis hukum Avogadro, yang menyatakan bahwa pada tekanan dan suhu tetap, volume gas berbanding lurus dengan jumlah mol gas yang ada. Dari Gambar 5.6 kita melihat bahwa k₄ = RT/P.
Menurut hukum Avogadro dapat dilihat bahwa ketika dua gas bereaksi satu sama lain, volume reaksi gas-gas memiliki rasio sederhana antara satu sama lain. Jika produk tersebut berupa gas, volumenya terkait dengan volume reaktan dengan rasio sederhana (fakta yang ditunjukkan sebelumnya oleh Gay-Lussac). Sebagai contoh, perhatikan sintesis amonia dari molekul hidrogen dan molekul nitrogen
Karena, pada suhu dan tekanan yang sama, volume gas berbanding lurus dengan jumlah mol gas yang ada, sekarang dapat ditulis
Rasio volume molekul hidrogen dengan molekul nitrogen adalah 3: 1, dan amonia (produk) dengan jumlah volume molekul hidrogen dan mol molekul nitrogen (reaktan) adalah 2:4 atau 1:2 (Gambar 5.10 ).
Gambar 5.10 Hubungan volume gas dalam suatu reaksi kimia. Rasio volume molekul hidrogen dengan molekul nitrogen adalah 3:1, dan amonia (produk) dengan molekul hidrogen dan molekul nitrogen yang digabungkan (reaktan) adalah 2:4, atau 1:2.
Contoh-contoh kerja yang menggambarkan hukum gas disajikan pada Bagian 5.4.