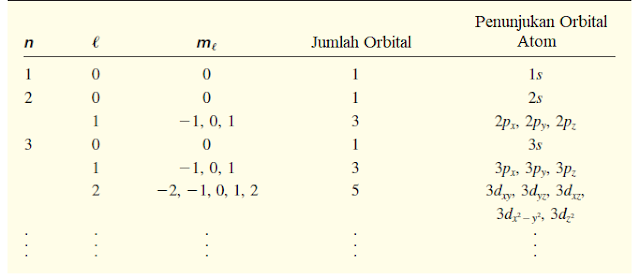
Tabel 7.2 menunjukkan hubungan antara bilangan kuantum dan orbital atom. Kita melihat bahwa ketika 𝓁 = 0, (2𝓁 + 1) = 1 dan hanya ada satu nilai mℓ, maka kita memiliki orbital s. Ketika 𝓁 = 1, (2𝓁 + 1) = 3, maka ada tiga nilai orbital mℓ atau tiga p, berlabel px, py, dan pz. Ketika 𝓁 = 2, (2𝓁 + 1) = 5 dan ada lima nilai mℓ, dan lima orbital yang sesuai diberi label dengan subskrip yang lebih rumit. Pada bagian berikut ini kita akan memperhatikan orbital s, p, dan d secara terpisah.
Tabel 7.2 Hubungan Antara Bilangan Kuantum dan Orbital Atom
Orbital s. Salah satu pertanyaan penting yang perlu kita tanyakan ketika mempelajari sifat-sifat orbital atom adalah, Apa saja bentuk orbital? Sebenarnya, orbital tidak memiliki bentuk yang terdefinisi dengan baik karena fungsi gelombang yang mencirikan orbital memanjang dari inti hingga tak terbatas. Dalam hal ini, sulit untuk mengatakan seperti apa bentuk orbital itu. Di sisi lain, tentu saja nyaman untuk berpikir bahwa orbital memiliki bentuk tertentu, khususnya dalam membahas pembentukan ikatan kimia antara atom, seperti yang akan kita lakukan pada Bab 9 dan Bab 10.
Meskipun pada prinsipnya sebuah elektron dapat ditemukan di mana saja, kita tahu bahwa sebagian besar waktu elektron cukup dekat dengan inti. Gambar 7.18 (a) menunjukkan distribusi kerapatan elektron dalam orbital hidrogen 1s yang bergerak keluar dari inti. Seperti yang Anda lihat, kerapatan elektron turun dengan cepat ketika jarak dari inti meningkat. Secara kasar, ada sekitar 90 persen kemungkinan menemukan elektron dalam radius 100 pm (1 pm = 1 x 10⁻¹² m) yang mengelilingi inti. Dengan demikian, kita dapat mewakili orbital 1s dengan menggambar diagram batas permukaan yang membungkus sekitar 90 persen dari total kerapatan elektron dalam orbital, seperti yang ditunjukkan pada Gambar 7.18 (b). Orbital 1s yang ditampilkan dengan cara ini hanyalah bola.
Gambar 7.18 (a) Plot kerapatan elektron dalam orbital hidrogen 1s sebagai fungsi jarak dari inti. Kerapatan elektron jatuh dengan cepat ketika jarak dari inti meningkat. (b) diagram batas permukaan orbital hidrogen 1s. (c) Cara yang lebih realistis untuk melihat distribusi kerapatan elektron adalah dengan membagi orbital 1s menjadi cangkang tipis bulat yang berurutan. Plot kemungkinan menemukan elektron di setiap kulit, yang disebut probabilitas radial, sebagai fungsi jarak menunjukkan maksimum pada 52,9 pm dari inti. Menariknya, ini sama dengan jari-jari orbit terdalam pada model Bohr.
Gambar 7.19 menunjukkan diagram batas permukaan untuk orbital atom hidrogen 1s, 2s, dan 3s. Semua orbital s berbentuk bola tetapi memiliki ukuran berbeda, yang meningkat seiring dengan meningkatnya jumlah kuantum utama. Meskipun detail variasi kerapatan elektron dalam setiap permukaan batas hilang, tidak ada kerugian serius. Bagi kita fitur paling penting dari orbital atom adalah bentuk dan ukuran relatifnya, yang secara memadai diwakili oleh diagram permukaan batas.
Gambar 7.19 Diagram batas permukaan orbital hidrogen 1s, 2s, dan 3s. Setiap bola mengandung sekitar 90 persen dari total kerapatan elektron. Semua orbital s berbentuk bola. Secara kasar, ukuran orbital sebanding dengan n², di mana n adalah bilangan kuantum utama.
Orbital p. Harus jelas bahwa orbital p mulai dengan bilangan kuantum utama n = 2. Jika n = 1, maka bilangan kuantum momentum sudut 𝓁 hanya dapat mengasumsikan nilai nol; oleh karena itu, hanya ada orbital 1s. Seperti yang kita lihat sebelumnya, ketika 𝓁 = 1, bilangan kuantum magnetik mℓ dapat memiliki nilai -1, 0, 1. Dimulai dengan n = 2 dan 𝓁 = 1, maka kita memiliki tiga orbital 2p: 2px, 2py, dan 2pz (Gambar 7.20). Subskrip huruf menunjukkan sumbu sepanjang orientasi orbital. Ketiga orbital p ini identik dalam ukuran, bentuk, dan energi; mereka berbeda satu sama lain hanya dalam orientasi. Perhatikan, bagaimanapun, bahwa tidak ada hubungan sederhana antara nilai-nilai mℓ dan arah x, y, dan z. Untuk tujuan kita, Anda hanya perlu mengingat bahwa karena ada tiga kemungkinan nilai mℓ, ada tiga orbital p dengan orientasi yang berbeda.
Diagram batas permukaan orbital p pada Gambar 7.20 menunjukkan bahwa setiap orbital p dapat dianggap sebagai dua lobus pada sisi berlawanan dari inti. Seperti orbital s, orbital p bertambah dalam ukuran dari orbital 2p menjadi 3p hingga 4p dan seterusnya.
Gambar 7.20 Diagram batas permukaan dari tiga orbital 2p. Orbital-orbital ini memiliki bentuk dan energi yang identik, tetapi orientasinya berbeda. Orbital p dari bilangan kuantum utama yang lebih tinggi memiliki bentuk yang serupa.
Orbital d dan Orbital Berenergi Tinggi Lainnya. Ketika 𝓁 = 2, ada lima nilai mℓ, yang sesuai dengan lima orbital. Nilai terendah dari n untuk sebuah orbital d adalah 3. Karena 𝓁 tidak pernah bisa lebih besar dari n - 1, ketika n = 3 dan 𝓁 = 2, kita memiliki lima orbital d (3dxy, 3dyz, 3dxz, 3dx²-y², dan 3dz²), ditunjukkan pada Gambar 7.21. Seperti dalam kasus orbital p, orientasi orbital d yang berbeda sesuai dengan nilai mℓ yang berbeda, tetapi sekali lagi tidak ada korespondensi langsung antara orientasi yang diberikan dan nilai mℓ tertentu. Semua orbital 3d dalam atom identik dalam energi. Orbital d yang n lebih besar dari 3 (4d, 5d, ...) memiliki bentuk yang serupa.
Gambar 7.21 Diagram batas permukaan dari orbital 3d. Meskipun orbital 3dz² terlihat berbeda, ini setara dengan empat orbital lainnya dalam semua hal lainnya. Orbital d bilangan kuantum utama yang lebih tinggi memiliki bentuk yang serupa.
Orbital yang memiliki energi lebih tinggi dari orbital d diberi label f, g,. . . dan seterusnya. Orbital-orbital itu penting dalam memperhitungkan perilaku unsur-unsur dengan nomor atom lebih besar dari 57, tetapi bentuknya sulit untuk diwakili. Dalam kimia dasar, kita mengabaikan orbital yang memiliki nilai 𝓁 lebih besar dari 3 (orbital g dan seterusnya).
Contoh 7.6 dan 7.7 mengilustrasikan pelabelan orbital dengan bilangan kuantum dan perhitungan jumlah total orbital yang terkait dengan bilangan kuantum utama yang diberikan.
Contoh 7.6
Sebutkan nilai-nilai n, 𝓁, dan mℓ untuk orbital dalam subkulit 4d.
Strategi
Apa hubungan antara n, 𝓁, dan mℓ? Apa yang dilambangkan oleh "4" dan "d" dalam 4d?
Penyelesaian
Seperti yang kita lihat sebelumnya, angka yang diberikan dalam penunjukan subkulit adalah bilangan kuantum utama, jadi dalam kasus ini n = 4. Huruf itu menunjuk jenis orbital. Karena kita berhadapan dengan orbital d, 𝓁 = 2. Nilai mℓ dapat bervariasi dari -𝓁 sampai 𝓁. Oleh karena itu, mℓ bisa -2, -1, 0, 1, atau 2.
Periksa
Nilai n dan 𝓁 ditetapkan untuk 4d, tetapi mℓ dapat memiliki salah satu dari lima nilai, yang sesuai dengan lima orbital d.
Latihan
Berikan nilai-nilai bilangan kuantum yang terkait dengan orbital dalam subkulit 3p.
Contoh 7.7
Berapa jumlah total orbital yang terkait dengan bilangan kuantum utama n = 3?
Strategi
Untuk menghitung jumlah total orbital untuk nilai n yang diberikan, pertama-tama kita perlu menuliskan nilai yang mungkin dari 𝓁. Kita kemudian menentukan berapa banyak nilai mℓ yang dikaitkan dengan masing-masing nilai 𝓁. Jumlah total orbital sama dengan jumlah semua nilai mℓ.
Penyelesaian
Untuk n = 3, nilai yang mungkin dari 𝓁 adalah 0, 1, dan 2. Dengan demikian, ada satu orbital 3s (n = 3, 𝓁 = 0, dan mℓ = 0); ada tiga orbital 3p (n = 3, 𝓁 = 1, dan mℓ = -1, 0, 1); ada beberapa orbital 3d (n = 3, 𝓁 = 2, dan mℓ = -2, -1, 0, 1, 2). Jumlah total orbital adalah 1 + 3 = 5 = 9.
Periksa
Jumlah total orbital untuk nilai n adalah n². Jadi di sini kita memiliki 3² = 9. Bisakah Anda membuktikan validitas hubungan ini?
Latihan
Berapa jumlah total orbital yang terkait dengan bilangan kuantum utama n = 4?
Energi dari Orbital
Sekarang kita memiliki pemahaman tentang bentuk dan ukuran orbital atom, kita siap untuk menyelidiki energi relatifnya dan melihat bagaimana tingkat energi mempengaruhi pengaturan aktual elektron dalam atom.
Menurut Persamaan (7.5), energi elektron dalam atom hidrogen ditentukan semata-mata oleh bilangan kuantum utamanya. Dengan demikian, energi orbital hidrogen meningkat sebagai berikut (Gambar 7.22):
1s < 2s = 2p <3s = 3p = 3d < 4s =4p = 4d = 4f < ...
Gambar 7.22 Tingkat energi orbital dalam atom hidrogen. Setiap garis horizontal pendek mewakili satu orbital. Orbit dengan nomor kuantum utama yang sama (n) semuanya memiliki energi yang sama.
Meskipun distribusi kerapatan elektron berbeda dalam orbital 2s dan 2p, elektron hidrogen memiliki energi yang sama apakah itu dalam orbital 2s atau orbital 2p. Orbital 1s dalam atom hidrogen sesuai dengan kondisi paling stabil, keadaan dasar. Sebuah elektron yang berada di orbital ini paling kuat dipegang oleh inti karena paling dekat dengan inti. Sebuah elektron dalam orbital 2s, 2p, atau lebih tinggi dalam atom hidrogen berada dalam kondisi tereksitasi.
Gambaran energi lebih kompleks untuk atom berelektron banyak daripada hidrogen. Energi elektron dalam atom semacam itu tergantung pada jumlah kuantum momentum sudutnya dan juga pada jumlah kuantum utamanya (Gambar 7.23). Untuk atom berelektron banyak, tingkat energi 3d sangat dekat dengan tingkat energi 4s. Akan tetapi, energi total atom tidak hanya bergantung pada jumlah energi orbital tetapi juga pada energi tolakan antara elektron-elektron dalam orbital-orbital ini (masing-masing orbital dapat menampung hingga dua elektron, seperti yang akan kita lihat pada Bagian 7.8) . Ternyata energi total atom lebih rendah ketika subkulit 4s dipasang sebelum subkulit 3d. Gambar 7.24 menggambarkan urutan orbital atom yang ditempatkan dalam atom berelektron banyak. Kita akan mempertimbangkan contoh spesifik dalam Bagian 7.8.
Gambar 7.23 Tingkat energi orbital dalam atom berelektron banyak. Perhatikan bahwa tingkat energi tergantung pada nilai n dan 𝓁.
Gambar 7.24 Urutan di mana subkulit atom diisi dalam atom berelektron banyak. Mulailah dengan orbital 1s dan bergerak ke bawah, mengikuti arah panah. Jadi, urutannya sebagai berikut: 1s < 2s < 2p < 3s < 3p < 4s < 3d < . . . .



















No comments:
Post a Comment
Note: Only a member of this blog may post a comment.