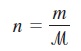Mari kita rangkum hukum gas yang baru saja didiskusikan di Bagian 5.3:
1. Hukum Boyle: V ∝ 1/P (pada n dan T tetap)
2. Hukum Charles: V ∝ T (pada n dan P tetap)
3. Hukum Avogadro: V ∝ n (pada P dan T tetap)
Kita dapat menggabungkan ketiga ungkapan ini menjadi persamaan induk tunggal untuk perilaku gas:
atau
PV = nRT (5.8)
di mana R, tetapan proporsionalitas, yang disebut konstanta gas. Persamaan (5.8), disebut persamaan gas ideal, untuk menggambarkan hubungan antara keempat variabel P, V, T, dan n. Gas ideal merupakan gas hipotetik yang perilaku tekanan-volume-suhunya dapat sepenuhnya dihitung dengan persamaan gas ideal. Molekul-molekul gas ideal tidak saling menarik atau menolak satu sama lain, dan volumenya dapat diabaikan terhadap volume wadahnya. Meskipun pada kenyataannya di alam tidak ada yang ditemukan sebagai gas ideal, perkiraan gas ideal bekerja dengan baik pada kisaran suhu dan tekanan yang paling masuk akal. Dengan demikian, dapat dengan aman menggunakan persamaan gas ideal untuk menyelesaikan masalah gas.
Sebelum dapat diterapkan persamaan gas ideal pada sistem nyata, harus dievaluasi konstanta gas R. Pada 0ºC (273,15 K) dan tekanan 1 atm, banyak gas nyata berperilaku seperti gas ideal. Eksperimen menunjukkan bahwa dalam kondisi ini, 1 mol gas ideal menempati 22,414 L, yang sedikit lebih besar daripada volume bola basket, seperti yang ditunjukkan pada Gambar 5.11. Keadaan 0ºC dan 1 atm disebut suhu dan tekanan standar, sering disingkat STP. Dari Persamaan (5.8) dapat ditulis
Gambar 5.11 Perbandingan volume molar pada STP (sekitar 22,4 L) dengan bola basket.
Titik-titik antara L dan atm dan antara K dan mol mengingatkan bahwa L dan atm berada pada pembilang dan K dan mol berada pada penyebutnya. Untuk sebagian besar perhitungan, akan dibulatkan nilai R menjadi tiga angka signifikan (0,0821 L⠄Atm/K⠄Mol) dan menggunakan 22,41 L untuk volume molar gas pada STP.
Contoh 5.3 menunjukkan bahwa jika diketahui kuantitas, volume dan suhu gas, maka dapat dihitung tekanannya menggunakan persamaan gas ideal. Kecuali dinyatakan sebaliknya, jika diasumsikan bahwa suhu yang diberikan dalam °C dalam perhitungan adalah tepat maka nilainya tidak mempengaruhi jumlah angka signifikan.
Contoh 5.3
Sulfur heksafluorida (SF₆) adalah gas yang tidak berwarna, tidak berbau, dan sangat tidak reaktif. Hitung tekanan (dalam atm) yang diberikan oleh 1,82 mol gas dalam bejana baja volume 5,43 L pada 69,5ºC.
Strategi
Soal diketahui jumlah mol gas dan volume serta suhu. Apakah gas mengalami perubahan dalam salah satu perilakunya? Persamaan apa yang harus digunakan untuk mengetahui tekanan? Satuan suhu apa yang harus digunakan?
Penyelesaian
Karena tidak ada perubahan perilaku gas yang terjadi, dapat digunakan persamaan gas ideal untuk menghitung tekanan. Dengan menyusun ulang Persamaan (5.8), dapat dituliskan
Latihan
Hitung volume (dalam liter) yang ditempati oleh 2,12 mol gas nitrogen oksida (NO) pada 6,54 atm dan 76ºC.
Dengan menggunakan fakta bahwa volume molar gas menempati 22,41 L pada STP, dapat dihitung volume gas pada STP tanpa menggunakan persamaan gas ideal.
Contoh 5.4
Strategi
Berapa volume satu mol gas ideal pada STP? Berapa mol yang ada pada 7,40 g NH₃?
Penyelesaian
Dengan mengetahui bahwa 1 mol gas ideal menempati 22,41 L pada STP dan menggunakan massa molar NH₃ (17,03 g), dapat dituliskan urutan konversinya sebagai berikut
gram NH₃ → mol NH₃ → liter NH₃ pada STP
jadi volume NH₃ diberikan oleh
Seringkali benar dalam kimia, khususnya dalam perhitungan hukum gas, bahwa soal-soal kimia dapat diselesaikan dengan lebih dari satu cara. Di sini soalnya juga dapat diselesaikan dengan mengkonversi 7,40 g NH₃, pertama menjadi jumlah mol NH₃, dan kemudian menerapkan persamaan gas ideal (V = nRT/P). Cobalah.
Periksa
Karena 7,40 g NH₃ lebih kecil dari massa molarnya, volumenya pada STP harus lebih kecil dari 22,41 L. Oleh karena itu, jawabannya masuk akal.
Periksa
Berapa volume (dalam liter) yang ditempati oleh 49,8 g gas HCl pada STP?
Ulasan Konsep
Dengan mengasumsikan perilaku gas ideal, manakah dari gas berikut yang akan memiliki volume terbesar pada STP? (a) 0,82 mol He. (b) 24 g N₂. (c) 5,0 x 10²³ molekul Cl₂.
Persamaan gas ideal berguna untuk soal yang tidak melibatkan perubahan P, V, T, dan n pada sampel gas. Jadi, jika diketahui ada tiga variabel, maka dapat dihitung variabel yang keempat menggunakan persamaan gas ideal. Namun, kadang-kadang, perlu dihadapi perubahan tekanan, volume, dan suhu, atau bahkan dalam jumlah gas. Ketika keadaan berubah, harus digunakan bentuk modifikasi dari persamaan gas ideal yang memperhitungkan kondisi awal dan akhir. Dapat diturunkan persamaan yang dimodifikasi sebagai berikut. Dari Persamaan (5.8),
sehingga
Sangat menarik untuk dicatat bahwa semua hukum gas yang dibahas dalam Bagian 5.3 dapat diturunkan dari Persamaan (5.9). Jika n₁ = n₂, seperti yang biasanya terjadi karena jumlah gas biasanya tidak berubah, maka persamaannya menjadi
Penerapan Persamaan (5.9) ditunjukkan dalam Contoh 5.5, 5.6, dan 5.7.
Contoh 5.5
Balon helium yang dipompa sampai volume 0,55 L pada tekanan permukaan laut (1,0 atm) yang dibiarkan naik sampai ketinggian 6,5 km, di mana tekanannya sekitar 0,40 atm. Dengan mengasumsikan bahwa suhu tetap, berapakah volume akhir balon?
Strategi
Jumlah gas di dalam balon dan suhunya tetap, tetapi tekanan dan volumenya berubah. Hukum gas apa yang dibutuhkan?
Dimulai dengan Persamaan (5.9)
Karena n₁ = n₂ dan T₁ = T₂,
P₁V₁ = P₂V₂
yang merupakan hukum Boyle [lihat Persamaan (5.2)]. Informasi yang diberikan ditabulasikan sebagai berikut:
Kondisi Awal Kondisi Akhir
P₁ = 1,0 atm P₂ = 0,40 atm
V₁ = 0,55 L V₂ =?
Sehingga,
Periksa
Ketika tekanan yang diberikan pada balon dikurangi (pada suhu tetap), gas helium mengembang dan volume balon meningkat. Volume akhir lebih besar dari volume awal, jadi jawabannya masuk akal.
Latihan
Sampel gas klor menempati volume 946 mL pada tekanan 726 mmHg. Hitung tekanan gas (dalam mmHg) jika volumenya berkurang pada suhu tetap menjadi 154 mL.
Contoh 5.6
Argon adalah gas inert yang digunakan dalam bola lampu untuk memperlambat penguapan serat tungsten. Bola lampu tertentu yang mengandung argon pada 1,20 atm dan 18ºC dipanaskan sampai 85ºC pada volume tetap. Hitung tekanan akhirnya (dalam atm).
Strategi
Suhu dan tekanan argon berubah tetapi jumlah dan volume gas tetap. Persamaan apa yang akan digunakan untuk menyelesaikan tekanan akhir? Satuan suhu apa yang harus digunakan?
Penyelesaian
Karena n₁ = n₂ dan V₁ = V₂, Persamaan (5.9) menjadi
yang merupakan hukum Charles [lihat Persamaan (5.6)]. Selanjutnya dapat dituliskan
Keadaan Awal Keadaan Akhir
P₁ = 1.20 atm P₂ = ?
T₁ = (18 + 273) K = 291 K T₂ = (85 + 273) K = 358 K
Tekanan terakhir diberikan oleh
Periksa
Pada volume tetap, tekanan gas dalam jumlah tertentu berbanding lurus dengan suhu mutlaknya. Oleh karena itu peningkatan tekanan masuk akal.
Latihan
Sampel gas oksigen awalnya pada 0,97 atm didinginkan dari 21ºC menjadi -68ºC pada volume tetap. Berapa tekanan akhirnya (dalam atm)?
Contoh 5.7
Gelembung kecil naik dari dasar danau, di mana suhu dan tekanan 8ºC dan 6,4 atm, ke permukaan air, di mana suhu 25ºC dan tekanannya 1,0 atm. Hitung volume akhir (dalam mL) gelembung jika volume awalnya adalah 2,1 mL.
Strategi
Dalam memecahkan masalah semacam ini, di mana banyak informasi yang diberikan, kadang-kadang sangat membantu dalam membuat sketsa keadaan, seperti yang ditunjukkan di sini:


Apa satuan suhu yang harus digunakan dalam perhitungan?
Penyelesaian
Menurut Persamaan (5.9)
Dengan berasumsi bahwa jumlah udara dalam gelembung tetap, yaitu, n₁ = n₂ sehingga
yaitu Persamaan (5.10). Informasi yang diberikan dapat dirangkum:
Keadaan Awal Keadaan Akhir
P₁ = 6,4 atm P₂ = 1,0 atm
V₁ = 2,1 mL V₂ = ?
T₁ = (8 + 273) K = 281 K T₂ = (25 + 273) K = 298 K
Dengan menata ulang Persamaan (5.10) diperoleh
Periksa
Perlu dilihat bahwa volume akhir melibatkan perkalian volume awal dengan rasio tekanan (P₁/P₂) dan rasio suhu (T₂/T₁). Ingat bahwa volume berbanding terbalik dengan tekanan, dan volume berbanding lurus dengan suhu. Karena tekanan berkurang dan suhu meningkat ketika gelembung naik, maka diharapkan volume gelembung meningkat. Bahkan, di sini perubahan tekanan memainkan peran yang lebih besar dalam perubahan volume.
Latihan
Suatu gas yang awalnya bervolume 4,0 L pada 1,2 atm, dan 66ºC mengalami perubahan sehingga volume dan suhu akhirnya adalah 1,7 L dan 42ºC. Berapa tekanan akhirnya? Asumsikan jumlah mol tetap tidak berubah.
Perhitungan Densitas/Kerapatan
Jika diatur ulang persamaan gas ideal, dapat dihitung kerapatan gas:
Jumlah mol gas, n, diberikan oleh persamaan
di mana m adalah massa gas dalam gram dan ℳ adalah massa molarnya. Karena itu
Karena kerapatan (d) adalah massa per satuan volume, dapat dituliskan
Tidak seperti molekul dalam materi terkondensasi (yaitu, dalam cairan dan padatan), molekul gas dipisahkan oleh jarak yang besar dibandingkan dengan ukurannya. Akibatnya, kerapatan gas sangat rendah di bawah keadaan atmosfer. Karena alasan ini, kerapatan gas biasanya dinyatakan dalam gram per liter (g/L) daripada gram per mililiter (g/mL), seperti ditunjukkan pada Contoh 5.8.
Contoh 5.8
Hitung kerapatan karbon dioksida (CO₂) dalam gram per liter (g/L) pada 0,990 atm dan 55ºC.
Strategi
Diperlukan Persamaan (5.11) untuk menghitung kerapatan gas. Apakah informasi yang memadai disediakan dalam soal? Apa satuan suhu yang harus digunakan?
Penyelesaian
Untuk menggunakan Persamaan (5.11), dapat diubah suhu menjadi Kelvin (T = 273 + 55 = 328 K) dan menggunakan 44,01 g untuk massa molar CO₂:
Sebagai alternatif, dapat diselesaikan kerapatan dengan menuliskan
Dengan asumsi bahwa ada 1 mol CO₂, massanya 44,01 g. Volume gas dapat diperoleh dari persamaan gas ideal
Oleh karena itu, kerapatan CO₂ diberikan oleh
Komentar
Dalam satuan gram per mililiter, kerapatan gas adalah 1,62 x 10⁻³ g/mL, yang jumlahnya sangat kecil. Sebagai perbandingan, kerapatan air adalah 1,0 g/mL dan emas adalah 19,3 g/cm³.
Latihan
Berapa kerapatan (dalam g/L) uranium heksafluorida (UF₆) pada 779 mmHg dan 62ºC?
Massa Molar Zat Berwujud Gas
Dari apa yang telah dipelajari sejauh ini, mungkin ada kesan bahwa massa molar suatu zat ditemukan dengan memeriksa rumus kimianya dan menjumlahkan massa molar atom komponennya. Namun, prosedur ini hanya berfungsi jika rumus kimia zat yang sebenarnya telah diketahui. Dalam kenyataannya, ahli kimia sering berurusan dengan zat-zat yang tidak diketahui atau hanya sebagian komposisinya saja yang telah diketahui. Jika zat yang tidak diketahui berbentuk gas, massa molarnya tetap dapat ditemukan berkat adanya persamaan gas ideal. Semua yang diperlukan adalah nilai kerapatan yang telah ditentukan secara eksperimen (atau data massa dan volume) untuk gas pada suhu dan tekanan yang diketahui. Dengan mengatur ulang Persamaan (5.11) didapatkan
Dalam percobaan tertentu, bola lampu dengan volume yang diketahui diisi dengan zat gas yang diteliti. Suhu dan tekanan sampel gas dicatat, dan massa total bola lampu ditambah sampel gas ditentukan (Gambar 5.12). Bola lampu kemudian dievakuasi (dikosongkan) dan ditimbang lagi. Perbedaan massa adalah massa gas. Kerapatan gas sama dengan massanya dibagi dengan volume bola lampu. Setelah diketahui kerapatan gas, dapat dihitung massa molar zat menggunakan Persamaan (5.12). Tentu saja, spektrometer massa akan menjadi instrumen ideal untuk menentukan massa molar, tetapi tidak semua ahli kimia mampu membelinya.
Gambar 5.12 Alat untuk mengukur kerapatan gas. Bola dengan volume yang diketahui diisi dengan gas yang diteliti pada suhu dan tekanan tertentu. Pertama bola ditimbang, dan kemudian dikosongkan (dievakuasi) dan ditimbang lagi. Perbedaan massa memberikan massa gas. Dengan mengetahui volume bola lampu, kita bisa menghitung kerapatan gas. Dalam kondisi atmosfer, 100 mL udara memiliki berat sekitar 0,12 g, jumlah yang mudah diukur.
Contoh 5.9 menunjukkan metode kerapatan untuk penentuan massa molar.
Contoh 5.9
Seorang ahli kimia telah mensintesis senyawa gas klorin dan oksigen berwarna kuning kehijauan dan menemukan bahwa kerapatannya adalah 7,71 g/L pada suhu 36ºC dan 2,88 atm. Hitung massa molar senyawa dan tentukan rumus molekulnya.
Strategi
Karena Persamaan (5.11) dan (5.12) adalah pengaturan ulang antara satu sama lain, dapat dihitung massa molar gas jika diketahui kerapatan, suhu, dan tekanannya. Rumus molekul senyawa harus konsisten dengan massa molarnya. Apa satuan suhu yang harus digunakan?
Penyelesaian
Dari Persamaan (5.12)
Atau, dapat diselesaikan untuk massa molar dengan menuliskan
Dari kerapatan yang diberikan diketahui ada 7,71 g gas dalam 1 L. Jumlah mol gas dalam volume ini dapat diperoleh dari persamaan gas ideal
Oleh karena itu, massa molar senyawa diberikan oleh persamaan
Untuk menentukan rumus molekul senyawa dengan cara coba-coba, hanya menggunakan pengetahuan massa molar klorin (35,45 g) dan oksigen (16,00 g). Diketahui bahwa suatu senyawa yang mengandung satu atom Cl dan satu atom O akan memiliki massa molar 51,45 g, yang terlalu rendah, sedangkan massa molar suatu senyawa terdiri dari dua atom Cl dan satu atom O adalah 86,90 g, yang terlalu tinggi. Dengan demikian, senyawa tersebut harus mengandung satu atom Cl dan dua atom O dan memiliki rumus ClO₂, yang memiliki massa molar 67,45 g.
Latihan
Kerapatan gas suatu senyawa organik adalah 3,38 g/L pada 40ºC dan 1,97 atm. Berapa massa molarnya?
Karena Persamaan (5.12) berasal dari persamaan gas ideal, juga dapat dihitung massa molar suatu zat gas menggunakan persamaan gas ideal, seperti ditunjukkan dalam Contoh 5.10.
Contoh 5.10
Analisis kimia gas suatu senyawa menunjukkan bahwa senyawa itu mengandung 33,0 persen silikon (Si) dan 67,0 persen florin (F) berdasarkan massa. Pada 35°C, 0,210 L senyawa memberikan tekanan 1,70 atm. Jika massa 0,210 L senyawa adalah 2,38 g, tentukan rumus molekul senyawa tersebut.
Strategi
Masalah ini dapat dibagi menjadi dua bagian. Pertama, soal meminta rumus empiris senyawa dari persen berdasarkan massa Si dan F. Kedua, informasi yang diberikan memungkinkan untuk menghitung massa molar senyawa dan karenanya dapat ditentukan rumus molekulnya. Apa hubungan antara massa molar empiris dan massa molar yang dihitung dari rumus molekul?
Penyelesaian
Dengan mengikuti prosedur dalam Contoh 3.9 untuk menghitung rumus empiris dengan mengasumsikan bahwa ada 100 g senyawa, sehingga persentase diubah menjadi gram. Jumlah mol Si dan F diberikan oleh
Oleh karena itu, rumus empirisnya adalah Si₁,₁₇ F₃,₅₃, atau, dibagi dengan indeks atau subskrip yang lebih kecil (1,17), diperoleh SiF₃.
Untuk menghitung massa molar senyawa, pertama-tama perlu dihitung jumlah mol yang terkandung dalam 2,38 g senyawa. Dari persamaan gas ideal
Karena ada 2,38 g dalam 0,0141 mol senyawa, massa dalam 1 mol, atau massa molar, diberikan oleh
Massa molar rumus empiris SiF₃ adalah 85,09 g. Ingatlah bahwa rasio (massa molar/massa molar empiris) selalu berupa bilangan bulat (169/85,09 = 2). Oleh karena itu, rumus molekul senyawa seharusnya (SiF₃)₂ atau Si₂F₆.
Latihan
Suatu senyawa gas mengandung 78,14 persen boron dan 21,86 persen hidrogen. Pada 27°C, 74,3 mL gas memberikan tekanan 1,12 atm. Jika massa gas adalah 0,0934 g, tentukan rumus molekulnya?