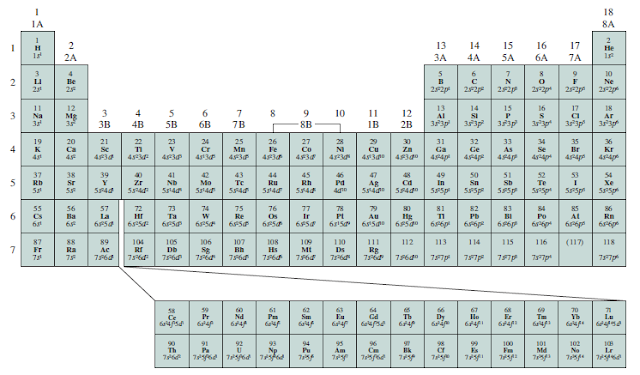
Gambar 8.2 menunjukkan tabel periodik bersama dengan konfigurasi elektron kulit terluar keadaan dasar dari unsur-unsur. (Konfigurasi elektron dari unsur-unsur tersebut juga diberikan pada Tabel 7.3.) Dimulai dengan hidrogen, kita melihat bahwa subkulit disusun dalam urutan yang ditunjukkan pada Gambar 7.24. Menurut jenis subkulit yang sedang diisi, unsur-unsurnya dapat dibagi menjadi beberapa kategori — unsur representatif, gas mulia, unsur transisi (atau logam transisi), lantanida, dan aktinida. Unsur representatif (juga disebut unsur golongan utama) adalah unsur dalam Golongan 1A hingga 7A, yang semuanya memiliki subkulit yang tidak lengkap (tidak penuh) dari bilangan kuantum utama tertinggi. Dengan pengecualian helium, gas mulia (unsur Golongan 8A) semuanya memiliki subkulit penuh. (Konfigurasi elektron adalah 1s² untuk helium dan ns² np⁶ untuk gas mulia lainnya, di mana n adalah bilangan kuantum utama untuk kulit terluar.)
Gambar 8.2 Konfigurasi elektron keadaan dasar dari unsur. Untuk memudahkan, hanya konfigurasi elektron terluar yang dituliskan.
Logam transisi adalah unsur dalam Golongan 1B dan 3B hingga 8B, yang memiliki subkulit d yang tidak lengkap, atau mudah menghasilkan kation dengan subkulit d yang tidak terisi penuh. (Logam-logam ini kadang-kadang disebut sebagai unsur transisi blok d.) Penomoran tidak berurutan dari logam transisi dalam tabel periodik (yaitu, 3B-8B, diikuti oleh 1B-2B) mengakui hubungan antara konfigurasi elektron terluar unsur-unsur ini dan unsur-unsur representatif. Sebagai contoh, skandium dan galium keduanya memiliki tiga elektron terluar. Namun, karena mereka berada dalam berbagai jenis orbital atom, mereka ditempatkan dalam golongan yang berbeda (3B dan 3A). Logam besi (Fe), kobalt (Co), dan nikel (Ni) tidak memenuhi klasifikasi ini dan semuanya ditempatkan di Golongan 8B. Unsur-unsur Golongan 2B, Zn, Cd, dan Hg, bukanlah unsur yang representatif atau logam transisi. Tidak ada nama khusus untuk golongan logam ini. Perlu dicatat bahwa penunjukan golongan A dan B tidak universal. Di Eropa praktiknya adalah menggunakan B untuk unsur representatif dan A untuk logam transisi, yang merupakan kebalikan dari konvensi Amerika. Persatuan Internasional Kimia Murni dan Terapan atau International Union of Pure and Applied Chemistry (IUPAC) telah merekomendasikan penomoran kolom secara berurutan dengan angka Arab 1 sampai 18 (lihat Gambar 8.2). Proposal ini telah memicu banyak kontroversi di komunitas kimia internasional, dan kelebihan dan kekurangannya akan dibahas untuk beberapa waktu ke depan. Dalam teks ini kita akan mengikuti aturan Amerika.
Lantanida dan aktinida kadang-kadang disebut unsur transisi blok f karena unsur-unsur ini telah mengisi subkulit f secara tidak lengkap. Gambar 8.3 membedakan golongan unsur yang dibahas di sini.
Reaktivitas kimia unsur-unsur sebagian besar ditentukan oleh elektron valensinya, yang merupakan elektron terluar. Untuk unsur-unsur yang representatif, elektron valensi adalah elektron yang berada dalam kulit terluar yang diduduki. Semua elektron nonvalensi dalam atom disebut sebagai elektron inti. Melihat konfigurasi elektron dari unsur representatif sekali lagi, pola yang jelas muncul: semua unsur dalam golongan yang diberikan memiliki jumlah dan jenis elektron valensi yang sama. Kesamaan konfigurasi elektron valensi adalah apa yang membuat unsur-unsur dalam golongan yang sama saling menyerupai satu sama lain dalam sifat kimia. Jadi, misalnya, logam alkali (unsur-unsur Golongan 1A) semuanya memiliki konfigurasi elektron valensi ns¹ (Tabel 8.1) dan unsur-unsur ini semua cenderung kehilangan satu elektron membentuk kation bermuatan positif satu. Demikian pula, logam alkali tanah (unsur Golongan 2A) semuanya memiliki konfigurasi elektron valensi ns², dan semuanya cenderung kehilangan dua elektron membentuk kation positif dua. Namun, kita harus berhati-hati dalam memprediksi sifat unsur hanya berdasarkan “keanggotaan golongan”. Misalnya, unsur-unsur dalam Golongan 4A semuanya memiliki konfigurasi elektron valensi yang sama ns² np², tetapi ada variasi penting dalam sifat kimia di antara unsur-unsur: karbon adalah bukan logam, silikon dan germanium adalah metaloid, dan timah dan timbal adalah logam.
Sebagai sebuah golongan, gas mulia bersifat sangat mirip. Helium dan neon bersifat inert secara kimia, dan ada beberapa contoh senyawa yang dibentuk oleh gas mulia lainnya. Kurangnya reaktivitas kimia ini disebabkan oleh subkulit ns dan np yang benar-benar penuh, suatu kondisi yang sering berkorelasi dengan stabilitas besar. Meskipun konfigurasi elektron valensi dari logam transisi tidak selalu sama di dalam suatu kelompok dan tidak ada pola umum dalam perubahan konfigurasi elektron dari satu logam ke logam berikutnya dalam periode yang sama, semua logam transisi memiliki banyak karakteristik yang berbeda yang membedakannya dari unsur-unsur lain. Alasannya adalah bahwa semua logam ini memiliki subkulit yang tidak terisi penuh. Demikian juga, unsur-unsur lantanida (dan aktinida) saling menyerupai satu sama lain karena mereka memiliki subkulit f yang tidak lengkap atau tidak penuh.
Contoh 8.1
Atom dari unsur tertentu memiliki 15 elektron. Tanpa melihat tabel periodik, jawablah pertanyaan-pertanyaan berikut: (a) Apa konfigurasi elektron keadaan-dasar dari unsur tersebut? (b) Bagaimana unsur tersebut harus diklasifikasikan? (c) Apakah unsur itu diamagnetik atau paramagnetik?
Strategi
(a) Kita merujuk pada prinsip pengembangan yang dibahas dalam Bagian 7.9 dan mulai menulis konfigurasi elektron dengan bilangan kuantum utama n=1 dan melanjutkan ke atas hingga semua elektron diperhitungkan. (b) Apa karakteristik konfigurasi elektron dari unsur representatif? unsur transisi? gas mulia? (c) Periksa skema pasangan elektron di kulit terluar. Apa yang menentukan apakah suatu unsur diamagnetik atau paramagnetik?
Penyelesaian
(a) Kita tahu bahwa untuk n=1 kita memiliki orbital 1s (2 elektron); untuk n=2 kita memiliki orbital 2s (2 elektron) dan tiga orbital 2p (6 elektron); untuk n=3 kita memiliki orbital 3s (2 elektron). Jumlah elektron yang tersisa adalah 15 - 12 = 3 dan ketiga elektron ini ditempatkan dalam orbital 3p. Konfigurasi elektron adalah 1s² 2 s² 2p⁶ 3s² 3p³.
(b) Karena sub kulit 3p tidak terisi penuh, ini adalah unsur yang representatif. Berdasarkan informasi yang diberikan, kita tidak bisa mengatakan apakah itu logam, bukan logam, atau metaloid.
(c) Menurut aturan Hund, tiga elektron dalam orbital 3p memiliki putaran paralel (tiga elektron tidak berpasangan). Oleh karena itu, unsur tersebut bersifat paramagnetik.
Periksa
Untuk (b), perhatikan bahwa logam transisi memiliki subkulit yang tidak terisi penuh dan gas mulia memiliki kulit terluar yang sepenuhnya terisi. Untuk (c), ingat bahwa jika atom suatu unsur mengandung jumlah elektron ganjil, maka unsur tersebut harus paramagnetik.
Latihan
Atom dari unsur tertentu memiliki 20 elektron. (a) Tulis konfigurasi elektron keadaan dasar dari unsur tersebut, (b) klasifikasikan unsur tersebut, (c) tentukan apakah unsur tersebut diamagnetik atau paramagnetik.
Merepresentasi Unsur Bebas dalam Persamaan Kimia
Setelah mengklasifikasikan unsur berdasarkan konfigurasi elektron keadaan dasar, kita sekarang dapat melihat cara ahli kimia merepresentasi logam, metaloid, dan bukan logam sebagai unsur bebas dalam persamaan kimia. Karena logam tidak ada dalam satuan molekul diskrit, kita selalu menggunakan rumus empirisnya dalam persamaan kimia. Rumus empiris sama dengan simbol yang mereprentasi unsur. Sebagai contoh, rumus empiris untuk besi adalah Fe, sama dengan simbol untuk unsur.
Untuk unsur bukan logam tidak ada aturan tunggal. Karbon, misalnya, ada sebagai jaringan atom tiga dimensi yang luas, dan karenanya kita menggunakan rumus empirisnya (C) untuk merepresentasi unsur karbon dalam persamaan kimia. Tetapi hidrogen, nitrogen, oksigen, dan halogen ada sebagai molekul diatomik, jadi kita menggunakan rumus molekulnya (H₂, N₂, O₂, F₂, Cl₂, Br₂, I₂) dalam persamaan. Bentuk stabil fosfor adalah molekul (P₄), jadi kita menggunakan P₄. Untuk sulfur, para ahli kimia sering menggunakan rumus empiris (S) dalam persamaan kimia, bukan S₈, yang merupakan bentuk stabil. Jadi, alih-alih menulis persamaan untuk pembakaran sulfur sebagai berikut
Kita biasa menulis
Semua gas mulia adalah spesi monatomik; dengan demikian kita menggunakan simbolnya: He, Ne, Ar, Kr, Xe, dan Rn. Metaloid, seperti logam, semuanya memiliki jaringan tiga dimensi yang kompleks, dan kita juga merepresentasikannya dengan rumus empirisnya, yaitu simbolnya: B, Si, Ge, dan sebagainya.
Konfigurasi Elektron Kation dan Anion
Karena banyak senyawa ionik terdiri dari anion dan kation monoatomik, akan sangat membantu untuk mengetahui cara menulis konfigurasi elektron dari spesi ionik ini. Seperti halnya atom netral, kita menggunakan prinsip pengecualian Pauli dan aturan Hund dalam menulis konfigurasi elektron kation dan anion keadaan dasar. Kita akan mengelompokkan ion dalam dua kategori untuk diskusi.
i. Ion Berasal dari Unsur Representatif
Ion-ion yang terbentuk dari atom-atom unsur yang paling representatif memiliki konfigurasi elektron luar-gas mulia ns² np⁶. Dalam pembentukan kation dari atom unsur yang representatif, satu atau lebih elektron dilepaskan dari kulit n yang diduduki terluar. Konfigurasi elektron dari beberapa atom dan kation yang sesuai adalah sebagai berikut:
Perhatikan bahwa setiap ion memiliki konfigurasi gas mulia yang stabil.
Dalam pembentukan anion, satu atau lebih elektron ditambahkan ke kulit n yang terisi sebagian. Perhatikan contoh-contoh berikut:
H : 1s¹ H⁻ : 1s² atau [He]
F : 1s² 2s² 2p⁵ F⁻ : 1s² 2s² 2p⁶ atau [Ne]
O : 1s² 2s² 2p⁴ O²⁻ : 1s² 2s² 2p⁶ atau [Ne]
N : 1s² 2s² 2p³ N³⁻ : 1s² 2s² 2p⁶ atau [Ne]
Semua anion ini juga memiliki konfigurasi gas mulia yang stabil. Perhatikan bahwa F⁻, Na⁺, dan Ne (dan Al³⁺, O²⁻, dan N³⁻) memiliki konfigurasi elektron yang sama. Mereka dikatakan isoelektronik karena mereka memiliki jumlah elektron yang sama, dan karenanya konfigurasi elektron keadaan dasar yang sama. Jadi, H⁻ dan He juga isoelektronik.
ii. Kation Berasal dari Logam Transisi
Pada Bagian 7.9 kita melihat bahwa pada logam transisi baris pertama (Sc sampai Cu), orbital 4s selalu dipasang sebelum orbital 3d. Pertimbangkan mangan, yang konfigurasi elektronnya adalah [Ar] 4s² 3d⁵. Ketika ion Mn²⁺ terbentuk, kita mungkin berharap dua elektron akan dilepas dari orbital 3d untuk menghasilkan [Ar] 4s² 3d³. Faktanya, konfigurasi elektron Mn²⁺ adalah [Ar] 3d⁵! Alasannya adalah bahwa interaksi elektron-elektron dan elektron inti dalam atom netral bisa sangat berbeda dari yang ada di ionnya. Jadi, sedangkan orbital 4s selalu dituliskan sebelum orbital 3d di Mn, elektron dilepas dari orbital 4s dalam membentuk Mn²⁺ karena orbital 3d lebih stabil daripada orbital 4s pada ion logam transisi. Oleh karena itu, ketika kation terbentuk dari atom logam transisi, elektron selalu dikeluarkan pertama kali dari orbital ns dan kemudian dari orbital (n - 1)d.
Ingatlah bahwa sebagian besar logam transisi dapat membentuk lebih dari satu kation dan seringkali kation-kation tersebut tidak isoelektronik dengan gas mulia sebelumnya.
Lantanida dan aktinida kadang-kadang disebut unsur transisi blok f karena unsur-unsur ini telah mengisi subkulit f secara tidak lengkap. Gambar 8.3 membedakan golongan unsur yang dibahas di sini.
Reaktivitas kimia unsur-unsur sebagian besar ditentukan oleh elektron valensinya, yang merupakan elektron terluar. Untuk unsur-unsur yang representatif, elektron valensi adalah elektron yang berada dalam kulit terluar yang diduduki. Semua elektron nonvalensi dalam atom disebut sebagai elektron inti. Melihat konfigurasi elektron dari unsur representatif sekali lagi, pola yang jelas muncul: semua unsur dalam golongan yang diberikan memiliki jumlah dan jenis elektron valensi yang sama. Kesamaan konfigurasi elektron valensi adalah apa yang membuat unsur-unsur dalam golongan yang sama saling menyerupai satu sama lain dalam sifat kimia. Jadi, misalnya, logam alkali (unsur-unsur Golongan 1A) semuanya memiliki konfigurasi elektron valensi ns¹ (Tabel 8.1) dan unsur-unsur ini semua cenderung kehilangan satu elektron membentuk kation bermuatan positif satu. Demikian pula, logam alkali tanah (unsur Golongan 2A) semuanya memiliki konfigurasi elektron valensi ns², dan semuanya cenderung kehilangan dua elektron membentuk kation positif dua. Namun, kita harus berhati-hati dalam memprediksi sifat unsur hanya berdasarkan “keanggotaan golongan”. Misalnya, unsur-unsur dalam Golongan 4A semuanya memiliki konfigurasi elektron valensi yang sama ns² np², tetapi ada variasi penting dalam sifat kimia di antara unsur-unsur: karbon adalah bukan logam, silikon dan germanium adalah metaloid, dan timah dan timbal adalah logam.
Sebagai sebuah golongan, gas mulia bersifat sangat mirip. Helium dan neon bersifat inert secara kimia, dan ada beberapa contoh senyawa yang dibentuk oleh gas mulia lainnya. Kurangnya reaktivitas kimia ini disebabkan oleh subkulit ns dan np yang benar-benar penuh, suatu kondisi yang sering berkorelasi dengan stabilitas besar. Meskipun konfigurasi elektron valensi dari logam transisi tidak selalu sama di dalam suatu kelompok dan tidak ada pola umum dalam perubahan konfigurasi elektron dari satu logam ke logam berikutnya dalam periode yang sama, semua logam transisi memiliki banyak karakteristik yang berbeda yang membedakannya dari unsur-unsur lain. Alasannya adalah bahwa semua logam ini memiliki subkulit yang tidak terisi penuh. Demikian juga, unsur-unsur lantanida (dan aktinida) saling menyerupai satu sama lain karena mereka memiliki subkulit f yang tidak lengkap atau tidak penuh.
Contoh 8.1
Atom dari unsur tertentu memiliki 15 elektron. Tanpa melihat tabel periodik, jawablah pertanyaan-pertanyaan berikut: (a) Apa konfigurasi elektron keadaan-dasar dari unsur tersebut? (b) Bagaimana unsur tersebut harus diklasifikasikan? (c) Apakah unsur itu diamagnetik atau paramagnetik?
Strategi
(a) Kita merujuk pada prinsip pengembangan yang dibahas dalam Bagian 7.9 dan mulai menulis konfigurasi elektron dengan bilangan kuantum utama n=1 dan melanjutkan ke atas hingga semua elektron diperhitungkan. (b) Apa karakteristik konfigurasi elektron dari unsur representatif? unsur transisi? gas mulia? (c) Periksa skema pasangan elektron di kulit terluar. Apa yang menentukan apakah suatu unsur diamagnetik atau paramagnetik?
Penyelesaian
(a) Kita tahu bahwa untuk n=1 kita memiliki orbital 1s (2 elektron); untuk n=2 kita memiliki orbital 2s (2 elektron) dan tiga orbital 2p (6 elektron); untuk n=3 kita memiliki orbital 3s (2 elektron). Jumlah elektron yang tersisa adalah 15 - 12 = 3 dan ketiga elektron ini ditempatkan dalam orbital 3p. Konfigurasi elektron adalah 1s² 2 s² 2p⁶ 3s² 3p³.
(b) Karena sub kulit 3p tidak terisi penuh, ini adalah unsur yang representatif. Berdasarkan informasi yang diberikan, kita tidak bisa mengatakan apakah itu logam, bukan logam, atau metaloid.
(c) Menurut aturan Hund, tiga elektron dalam orbital 3p memiliki putaran paralel (tiga elektron tidak berpasangan). Oleh karena itu, unsur tersebut bersifat paramagnetik.
Periksa
Untuk (b), perhatikan bahwa logam transisi memiliki subkulit yang tidak terisi penuh dan gas mulia memiliki kulit terluar yang sepenuhnya terisi. Untuk (c), ingat bahwa jika atom suatu unsur mengandung jumlah elektron ganjil, maka unsur tersebut harus paramagnetik.
Latihan
Atom dari unsur tertentu memiliki 20 elektron. (a) Tulis konfigurasi elektron keadaan dasar dari unsur tersebut, (b) klasifikasikan unsur tersebut, (c) tentukan apakah unsur tersebut diamagnetik atau paramagnetik.
Merepresentasi Unsur Bebas dalam Persamaan Kimia
Setelah mengklasifikasikan unsur berdasarkan konfigurasi elektron keadaan dasar, kita sekarang dapat melihat cara ahli kimia merepresentasi logam, metaloid, dan bukan logam sebagai unsur bebas dalam persamaan kimia. Karena logam tidak ada dalam satuan molekul diskrit, kita selalu menggunakan rumus empirisnya dalam persamaan kimia. Rumus empiris sama dengan simbol yang mereprentasi unsur. Sebagai contoh, rumus empiris untuk besi adalah Fe, sama dengan simbol untuk unsur.
Untuk unsur bukan logam tidak ada aturan tunggal. Karbon, misalnya, ada sebagai jaringan atom tiga dimensi yang luas, dan karenanya kita menggunakan rumus empirisnya (C) untuk merepresentasi unsur karbon dalam persamaan kimia. Tetapi hidrogen, nitrogen, oksigen, dan halogen ada sebagai molekul diatomik, jadi kita menggunakan rumus molekulnya (H₂, N₂, O₂, F₂, Cl₂, Br₂, I₂) dalam persamaan. Bentuk stabil fosfor adalah molekul (P₄), jadi kita menggunakan P₄. Untuk sulfur, para ahli kimia sering menggunakan rumus empiris (S) dalam persamaan kimia, bukan S₈, yang merupakan bentuk stabil. Jadi, alih-alih menulis persamaan untuk pembakaran sulfur sebagai berikut
S₈(s) + 8O₂(g) → 8SO₂(g)
Kita biasa menulis
S(s) + O₂(g) → SO₂(g)
Semua gas mulia adalah spesi monatomik; dengan demikian kita menggunakan simbolnya: He, Ne, Ar, Kr, Xe, dan Rn. Metaloid, seperti logam, semuanya memiliki jaringan tiga dimensi yang kompleks, dan kita juga merepresentasikannya dengan rumus empirisnya, yaitu simbolnya: B, Si, Ge, dan sebagainya.
Konfigurasi Elektron Kation dan Anion
Karena banyak senyawa ionik terdiri dari anion dan kation monoatomik, akan sangat membantu untuk mengetahui cara menulis konfigurasi elektron dari spesi ionik ini. Seperti halnya atom netral, kita menggunakan prinsip pengecualian Pauli dan aturan Hund dalam menulis konfigurasi elektron kation dan anion keadaan dasar. Kita akan mengelompokkan ion dalam dua kategori untuk diskusi.
i. Ion Berasal dari Unsur Representatif
Ion-ion yang terbentuk dari atom-atom unsur yang paling representatif memiliki konfigurasi elektron luar-gas mulia ns² np⁶. Dalam pembentukan kation dari atom unsur yang representatif, satu atau lebih elektron dilepaskan dari kulit n yang diduduki terluar. Konfigurasi elektron dari beberapa atom dan kation yang sesuai adalah sebagai berikut:
Na : [Ne] 3s¹ Na⁺ : [Ne]
Ca : [Ar] 4s² Ca²⁺ : [Ar]
Al : [Ne] 3s² 3p¹ Al³⁺ : [Ne]Perhatikan bahwa setiap ion memiliki konfigurasi gas mulia yang stabil.
Dalam pembentukan anion, satu atau lebih elektron ditambahkan ke kulit n yang terisi sebagian. Perhatikan contoh-contoh berikut:
H : 1s¹ H⁻ : 1s² atau [He]
F : 1s² 2s² 2p⁵ F⁻ : 1s² 2s² 2p⁶ atau [Ne]
O : 1s² 2s² 2p⁴ O²⁻ : 1s² 2s² 2p⁶ atau [Ne]
N : 1s² 2s² 2p³ N³⁻ : 1s² 2s² 2p⁶ atau [Ne]
Semua anion ini juga memiliki konfigurasi gas mulia yang stabil. Perhatikan bahwa F⁻, Na⁺, dan Ne (dan Al³⁺, O²⁻, dan N³⁻) memiliki konfigurasi elektron yang sama. Mereka dikatakan isoelektronik karena mereka memiliki jumlah elektron yang sama, dan karenanya konfigurasi elektron keadaan dasar yang sama. Jadi, H⁻ dan He juga isoelektronik.
ii. Kation Berasal dari Logam Transisi
Pada Bagian 7.9 kita melihat bahwa pada logam transisi baris pertama (Sc sampai Cu), orbital 4s selalu dipasang sebelum orbital 3d. Pertimbangkan mangan, yang konfigurasi elektronnya adalah [Ar] 4s² 3d⁵. Ketika ion Mn²⁺ terbentuk, kita mungkin berharap dua elektron akan dilepas dari orbital 3d untuk menghasilkan [Ar] 4s² 3d³. Faktanya, konfigurasi elektron Mn²⁺ adalah [Ar] 3d⁵! Alasannya adalah bahwa interaksi elektron-elektron dan elektron inti dalam atom netral bisa sangat berbeda dari yang ada di ionnya. Jadi, sedangkan orbital 4s selalu dituliskan sebelum orbital 3d di Mn, elektron dilepas dari orbital 4s dalam membentuk Mn²⁺ karena orbital 3d lebih stabil daripada orbital 4s pada ion logam transisi. Oleh karena itu, ketika kation terbentuk dari atom logam transisi, elektron selalu dikeluarkan pertama kali dari orbital ns dan kemudian dari orbital (n - 1)d.
Ingatlah bahwa sebagian besar logam transisi dapat membentuk lebih dari satu kation dan seringkali kation-kation tersebut tidak isoelektronik dengan gas mulia sebelumnya.