
Geometri molekul adalah susunan atom tiga dimensi dalam suatu molekul. Geometri molekul mempengaruhi sifat fisika dan sifat kimia suatu molekul, seperti titik leleh, titik didih, kerapatan, dan jenis reaksi yang dialaminya. Secara umum, panjang ikatan dan sudut ikatan harus ditentukan dengan eksperimen. Namun, ada prosedur sederhana yang memungkinkan kita untuk memprediksi dengan akurasi tinggi geometri keseluruhan molekul atau ion jika kita mengetahui jumlah elektron yang mengelilingi atom pusat dalam struktur Lewis-nya. Dasar dari pendekatan ini adalah asumsi bahwa pasangan elektron di kulit valensi atom saling tolak-menolak. Kulit valensi adalah kulit atom terluar elektron terluar; kulit valensi memegang elektron yang biasanya terlibat dalam ikatan kimia. Dalam ikatan kovalen, sepasang elektron, sering disebut pasangan elektron ikatan, berperan untuk menyatukan dua atom. Namun, dalam molekul poliatomik, di mana ada dua ikatan atau lebih antara atom pusat dan atom-atom di sekitarnya, tolakan antar elektron dalam pasangan elektron ikatan yang berbeda menyebabkan mereka tetap terpisah sejauh mungkin. Geometri yang akhirnya diasumsikan oleh molekul (sebagaimana ditentukan oleh posisi semua atom) meminimalkan tolakan. Pendekatan untuk mempelajari geometri molekul ini disebut model Valensi-Shell Electron-Pair Repulsion (VSEPR), karena ini menjelaskan pengaturan geometri pasangan elektron di sekitar atom pusat dalam hal tolakan elektrostatik antara pasangan elektron.
Dua aturan umum mengatur penggunaan model VSEPR:
- Sejauh yang berkaitan dengan tolakan pasangan elektron, ikatan rangkap dan ikatan rangkap tiga dapat diperlakukan seperti ikatan tunggal. Perkiraan ini baik untuk tujuan kualitatif. Namun, kita harus menyadari bahwa pada kenyataannya ikatan rangkap "lebih besar" daripada ikatan tunggal; yaitu, karena ada dua atau tiga ikatan antara dua atom, kerapatan elektron menempati lebih banyak ruang.
- Jika sebuah molekul memiliki dua atau lebih struktur resonansi, kita dapat menerapkan model VSEPR ke salah satu dari mereka. Muatan formal biasanya tidak ditampilkan.
Dengan mengingat model ini, kita dapat memprediksi geometri molekul (dan ion) secara sistematis. Untuk tujuan ini, mudah untuk membagi molekul menjadi dua kategori, berdasarkan apakah atom pusat memiliki pasangan elektron bebas atau tidak.
Molekul Yang Atom Pusatnya Tidak Memiliki Pasangan Elektron Bebas
Untuk penyederhanaan kita akan mempertimbangkan molekul yang mengandung atom hanya dari dua unsur, A dan B, dimana A adalah atom pusat. Molekul-molekul ini memiliki rumus umum ABx, di mana x adalah bilangan bulat 2, 3,. . . . (Jika x = 1, kita memiliki molekul diatomik AB, yang linier sesuai definisi.) Dalam sebagian besar kasus, x adalah antara 2 sampai 6.
Tabel 10.1 menunjukkan beberapa kemungkinan pengaturan pasangan elektron di sekitar atom pusat A. Sebagai hasil dari tolakan timbal balik, pasangan elektron tinggal sejauh mungkin dari satu sama lain. Perhatikan bahwa Tabel 10.1 menunjukkan pengaturan pasangan elektron tetapi tidak pada posisi atom yang mengelilingi atom pusat. Molekul-molekul di mana atom pusat tidak memiliki pasangan elektron bebas memiliki salah satu dari lima pengaturan pasangan ikatan ini. Dengan menggunakan Tabel 10.1 sebagai referensi, mari kita perhatikan geometri molekul dengan rumus AB₂, AB₃, AB₄, AB₅, dan AB₆.
AB₂: Berilium Klorida (BeCl₂)
Struktur Lewis dari berilium klorida dalam bentuk gas adalah
Tabel 10.1 Pengaturan Pasangan Elektron Atom Pusat (A) dalam Molekul dan Geometri dari Beberapa Molekul dan Ion Sederhana di mana Atom Pusat Tidak Memiliki Pasangan Elektron Bebas
* Garis-garis berwarna hanya digunakan untuk menunjukkan bentuk keseluruhan; garis-garis bukan representasi ikatan.
Karena pasangan ikatan saling tolak, mereka harus berada di ujung yang berlawanan dari garis lurus agar mereka terpisah sejauh mungkin. Jadi, sudut Cl-Be-Cl diprediksi 180°, dan molekulnya linear (lihat Tabel 10.1). Model "ball-and-stick" BeCl₂ adalah
AB₃: Boron Trifluorida (BF₃)
Boron trifluorida mengandung tiga ikatan kovalen, atau pasangan elektron ikatan. Dalam pengaturan yang paling stabil, tiga ikatan BF menunjuk ke sudut-sudut segitiga sama sisi dengan B di tengah-tengah segitiga:
Menurut Tabel 10.1, geometri BF₃ adalah trigonal planar karena tiga atom ujungnya berada di sudut segitiga sama sisi, yaitu planar:
Dengan demikian, masing-masing dari tiga sudut F-B-F adalah 120°, dan keempat atom terletak pada bidang yang sama.
AB₄: Metana (CH₄)
Struktur Lewis dari metana adalah
Karena ada empat pasangan ikatan, geometri CH₄ adalah tetrahedral (lihat Tabel 10.1). Tetrahedral memiliki empat sisi (prefiks tetra berarti "empat"), atau muka, yang semuanya adalah segitiga sama sisi. Dalam molekul tetrahedral, atom pusat (C dalam hal ini) terletak di tengah tetrahedral dan empat atom lainnya berada di sudut-sudut. Sudut ikatan semuanya 109,5 °.
AB₅: Fosfor Pentaklorida (PCl₅)
Struktur Lewis fosfor pentaklorida (dalam fasa gas) adalah:
Satu-satunya cara untuk meminimalkan gaya tolak di antara pasangan lima ikatan adalah mengatur ikatan PCl dalam bentuk trigonal bipiramida (lihat Tabel 10.1). Trigonal bipiramida dapat dihasilkan dengan menggabungkan dua tetrahedral di bidang segitiga bersama:
Atom pusat (P dalam kasus ini) berada di tengah segitiga bersama dengan atom-atom di sekitarnya diposisikan di lima sudut trigonal bipiramida. Atom-atom yang berada di atas dan di bawah bidang segitiga dikatakan menempati posisi aksial, dan mereka yang berada di bidang segitiga dikatakan menempati posisi ekuator. Sudut antara dua ikatan ekuator adalah 120°; bahwa antara ikatan aksial dan ikatan ekuator adalah 90°, dan bahwa antara dua ikatan aksial adalah 180°.
AB₆: Belerang Heksafluorida (SF₆)
Struktur Lewis dari belerang heksafluorida adalah
Susunan yang paling stabil dari enam pasangan ikatan SF adalah dalam bentuk oktahedral, ditunjukkan pada Tabel 10.1. Sebuah oktahedral memiliki delapan sisi (prefiks okta berarti "delapan"). Itu dapat dihasilkan dengan menggabungkan dua piramida bujur sangkar pada bidang yang sama. Atom pusat (S dalam hal ini) berada di tengah-tengah bidang persegi dan atom-atom di sekitarnya berada di enam sudut. Semua sudut ikatan adalah 90° kecuali yang dibuat oleh ikatan antara atom pusat dan pasangan atom yang secara diametris saling berhadapan. Sudut itu 180°. Karena keenam ikatan tersebut setara dalam molekul oktahedral, kita tidak dapat menggunakan istilah "aksial" dan "ekuator" seperti pada molekul trigonal bipiramida.
Molekul Yang Atom Pusatnya Memiliki Satu atau Lebih Pasangan Elektron Bebas
Menentukan geometri molekul lebih rumit jika atom pusat memiliki pasangan elektron bebas (PEB) dan pasangan elektron ikatan PEI). Dalam molekul semacam itu ada tiga jenis gaya tolak — di antara PEI, di antara PEB, dan antara PEI dan PEB. Secara umum, menurut model VSEPR, gaya tolak menurun dengan urutan sebagai berikut:
tolakan PEB vs PEB > tolakan PEB vs PEI > tolakan PEI vs PEI
Elektron dalam sebuah ikatan dipegang oleh gaya tarik menarik yang diberikan oleh inti dari dua atom yang terikat. Elektron ini memiliki lebih sedikit "distribusi spasial" daripada pasangan elektron bebas; yaitu, mereka mengambil ruang lebih sedikit daripada elektron pasangan bebas, yang berhubungan dengan hanya satu atom tertentu. Karena elektron pasangan bebas dalam molekul menempati lebih banyak ruang, mereka mengalami tolakan yang lebih besar dari pasangan elektron bebas dan pasangan ikatan. Untuk melacak jumlah total pasangan ikatan dan pasangan elektron bebas, kita menunjuk molekul dengan pasangan elektron bebas sebagai ABxEy, di mana A adalah atom pusat, B adalah atom sekitarnya, dan E adalah pasangan elektron bebas pada A. Baik x dan y adalah bilangan bulat; x = 2, 3,. . . , dan y = 1, 2,. . . . Dengan demikian, nilai x dan y masing-masing menunjukkan jumlah atom di sekitarnya dan jumlah pasangan elektron bebas pada atom pusat. Molekul yang paling sederhana seperti itu adalah molekul triatomik dengan satu pasangan elektron bebas pada atom pusat dan rumusnya adalah AB₂E.
Seperti yang ditunjukkan contoh berikut, dalam kebanyakan kasus keberadaan pasangan elektron bebas pada atom pusat membuatnya sulit untuk memprediksi sudut ikatan secara akurat.
AB₂E: Belerang Dioksida (SO₂)
Struktur Lewis belerang dioksida adalah
Karena VSEPR memperlakukan ikatan rangkap seolah-olah ikatan tunggal, molekul SO₂ dapat dilihat terdiri dari tiga pasangan elektron pada atom pusat S. Dari jumlah tersebut, dua adalah pasangan elektron ikatan dan satu adalah pasangan elektron bebas. Dalam Tabel 10.1 kita melihat bahwa susunan keseluruhan dari tiga pasangan elektron adalah trigonal planar. Tetapi karena salah satu pasangan elektron adalah pasangan elektron bebas, molekul SO₂ memiliki bentuk "bengkok".
Karena tolakan pasangan bebas versus pasangan ikatan lebih besar daripada tolakan pasangan ikatan versus pasangan ikatan, dua ikatan belerang-ke-oksigen didorong bersama sedikit dan sudut OSO kurang dari 120°.
AB₃E: Ammonia (NH₃)
Molekul amonia mengandung tiga pasangan elektron ikatan dan satu pasangan elektron bebas:
Seperti yang ditunjukkan Tabel 10.1, susunan keseluruhan empat pasangan elektron adalah tetrahedral. Tetapi dalam NH₃ salah satu pasangan elektron adalah pasangan elektron bebas, sehingga geometri NH₃ adalah piramida trigonal (disebut demikian karena terlihat seperti piramida, dengan atom N di puncak). Karena pasangan bebas menolak pasangan elektron ikatan lebih kuat, tiga pasangan ikatan NH didorong lebih dekat bersama-sama:
Dengan demikian, sudut HNH dalam amonia lebih kecil dari sudut tetrahedral ideal 109,5 ° (Gambar 10.1).
Gambar 10.1 (a) Ukuran relatif dari pasangan elektron ikatan dan pasangan elektron bebas pada CH₄, NH₃, dan H₂O. (b) sudut ikatan dalam CH₄, NH₃, dan H₂O. Perhatikan bahwa garis putus-putus mewakili sumbu ikatan di belakang bidang kertas, garis terjepit mewakili sumbu ikatan di depan bidang datar, dan garis padat tipis mewakili ikatan di bidang datar.
AB₂E₂: Air (H₂O)
Molekul air mengandung dua pasangan elektron ikatan dan dua pasangan elektron bebas:
Susunan keseluruhan dari empat pasangan elektron dalam air adalah tetrahedral, sama seperti pada amonia. Namun, tidak seperti amonia, air memiliki dua pasangan elektron bebas pada atom pusat O. Pasangan elektron bebas ini cenderung sejauh mungkin dari satu sama lain. Akibatnya, dua pasangan elektron ikatan O-H didorong ke satu sama lain, dan kita memperkirakan penyimpangan yang lebih besar dari sudut tetrahedral daripada di NH₃. Seperti ditunjukkan pada Gambar 10.1, sudut HOH adalah 104,5 °. Geometri H₂O adalah bengkok:
AB₄E: Belerang Tetrafluorida (SF₄)
Struktur Lewis dari SF₄ adalah
Atom pusat S memiliki lima pasangan elektron yang pengaturannya, menurut Tabel 10.1, adalah trigonal bipiramida. Namun, dalam molekul SF₄, salah satu pasangan elektron adalah pasangan elektron bebas, sehingga molekul harus memiliki salah satu dari geometri berikut:
Tabel 10.2 Geometri Molekul dan Ion Sederhana di mana Atom Pusat Memiliki Satu atau Lebih Pasangan Elektron Bebas
Dalam (a) pasangan elektron bebas menempati posisi ekuator, dan pada (b) pasangan ini menempati posisi aksial. Posisi aksial memiliki tiga pasangan tetangga pada 90° dan satu pada 180°, sedangkan posisi ekuator memiliki dua pasangan tetangga pada 90° dan dua lagi pada 120°. Tolakan lebih kecil untuk (a), dan memang (a) adalah struktur yang diamati secara eksperimen. Bentuk ini kadang-kadang digambarkan sebagai tetrahedral yang terdistorsi (atau jungkat-jungkit jika kita memutar struktur 90° ke kanan untuk melihatnya). Sudut antara atom F dan S aksial adalah 173°, dan antara atom F dan S ekuator adalah 102°.
Tabel 10.2 menunjukkan geometri molekul sederhana di mana atom pusat memiliki satu atau lebih pasangan elektron bebas, termasuk beberapa yang belum kita diskusikan.
Geometri Molekul dengan Lebih dari Satu Atom Pusat
Sejauh ini kita telah membahas geometri molekul yang hanya memiliki satu atom pusat. Secara keseluruhan geometri molekul dengan lebih dari satu atom pusat sulit untuk didefinisikan dalam banyak kasus. Seringkali kita hanya dapat menggambarkan bentuk di sekitar masing-masing atom pusat. Sebagai contoh, pertimbangkan metanol, CH₃OH, yang struktur Lewis-nya ditunjukkan di bawah ini:
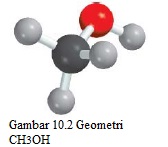
Dua atom pusat (nonterminal) dalam metanol adalah C dan O. Kita dapat mengatakan bahwa tiga pasangan elektron ikatan CH dan CO diatur secara tetrahedral dari atom C. Sudut ikatan HCH dan OCH adalah sekitar 109°. Atom O di sini seperti yang ada pada molekul air karena memiliki dua pasangan elektron bebas dan dua pasangan elektron ikatan. Oleh karena itu, bagian HOC dari molekul bengkok, dan sudut HOC kira-kira sama dengan 105° (Gambar 10.2).
Pedoman untuk Menerapkan Model VSEPR
Setelah mempelajari geometri molekul dalam dua kategori (atom pusat dengan dan tanpa pasangan elektron bebas), mari kita perhatikan beberapa aturan untuk menerapkan model VSEPR pada semua jenis molekul:
- Tulis struktur molekul Lewis, dengan mempertimbangkan hanya pasangan elektron di sekitar atom pusat (yaitu, atom yang terikat pada lebih dari satu atom lainnya).
- Hitung jumlah pasangan elektron di sekitar atom pusat (pasangan elektron ikatan dan pasangan elektron bebas). Perlakukan ikatan rangkap dua dan rangkap tiga seolah-olah itu ikatan tunggal. Lihat Tabel 10.1 untuk memprediksi pengaturan keseluruhan pasangan elektron.
- Gunakan Tabel 10.1 dan 10.2 untuk memprediksi geometri molekul.
- Dalam memprediksi sudut ikatan, perhatikan bahwa pasangan bebas menolak pasangan bebas lain atau pasangan ikatan lebih kuat dari pasangan ikatan menolak pasangan ikatan lainnya. Ingatlah bahwa secara umum tidak ada cara mudah untuk memprediksi sudut ikatan secara akurat ketika atom pusat memiliki satu atau lebih pasangan elektron bebas.
Model VSEPR menghasilkan prediksi geometri berbagai struktur molekul yang andal. Kimiawan menggunakan pendekatan VSEPR karena kesederhanaannya. Meskipun ada beberapa kekhawatiran teoritis tentang apakah "tolakan pasangan elektron" benar-benar menentukan bentuk molekul, asumsi bahwa hal itu mengarah pada prediksi yang berguna (dan umumnya dapat diandalkan). Kita tidak perlu bertanya lebih banyak tentang model apa pun pada tahap ini dalam studi ikatan kimia. Contoh 10.1 menggambarkan penerapan VSEPR.
Contoh 10.1
Gunakan model VSEPR untuk memprediksi geometri molekul dan ion berikut:
(a) AsH₃, (b) OF₂, (c) AlCl₄⁻, (d) I₃⁻, (e) C₂H₄.
Strategi
Urutan langkah-langkah dalam menentukan geometri molekul adalah sebagai berikut:
gambar struktur Lewis → temukan susunan pasangan elektron → temukan susunan pasangan ikatan → tentukan geometri berdasarkan pasangan ikatan
Larutan
(a) Struktur Lewis dari AsH₃ adalah
Ada empat pasangan elektron di sekitar atom pusat; oleh karena itu, pengaturan pasangan elektron adalah tetrahedral (lihat Tabel 10.1). Ingat bahwa geometri molekul hanya ditentukan oleh susunan atom (dalam hal ini atom As dan H). Dengan demikian, jika kita menghapus pasangan elektron bebas maka ada tiga pasangan elektron ikatan dengan geometri piramida trigonal, seperti NH₃. Kita tidak dapat memprediksi sudut HAsH secara akurat, tetapi kita tahu bahwa sudutnya kurang dari 109,5° karena tolakan pasangan elektron ikatan dalam ikatan As-H oleh pasangan elektron bebas pada As lebih besar daripada tolakan antara pasangan ikatan.
(b) Struktur Lewis OF₂ adalah
Ada empat pasangan elektron di sekitar atom pusat; oleh karena itu, pengaturan pasangan elektron adalah tetrahedral (lihat Tabel 10.1). Ingat bahwa geometri molekul hanya ditentukan oleh susunan atom (dalam hal ini atom O dan F). Dengan demikian, Jika kita menghapus dua pasangan elektron bebas maka ada dua pasangan elektron ikatan dengan geometri bengkok, seperti H₂O. Kita tidak dapat memprediksi sudut FOF secara akurat, tetapi kita tahu bahwa sudutnya harus kurang dari 109,5° karena tolakan pasangan elektron ikatan dalam ikatan OOF oleh pasangan elektron bebas pada O lebih besar daripada tolakan antara pasangan ikatan.
(c) Struktur Lewis dari AlCl₄⁻ adalah
Ada empat pasangan elektron di sekitar atom pusat; oleh karena itu, pengaturan pasangan elektron adalah tetrahedral. Karena tidak ada pasangan elektron bebas, pengaturan pasangan elektron ikatan adalah sama untuk semua pengaturan pasangan elektron. Oleh karena itu, AlCl₄⁻ memiliki geometri tetrahedral dan sudut ClAlCl semuanya 109,5°.
(d) Struktur Lewis I₃⁻ adalah
Ada lima pasangan elektron di sekitar atom pusat I; oleh karena itu, pengaturan pasangan elektron adalah trigonal bipiramida. Dari lima pasangan elektron, tiga pasangan elektron bebas dan dua pasangan elektron ikatan. Ingatlah bahwa pasangan elektron bebas secara istimewa menempati posisi ekuator dalam trigonal bipiramida (lihat Tabel 10.2). Dengan demikian, jika kita melepaskan pasangan elektron bebas maka ada dua pasangan elektron ikatan dengan geometri linier untuk I₃⁻, yaitu, ketiga atom I terletak pada garis lurus.
(e) Struktur Lewis dari C₂H₄ adalah
Ikatan C=C diperlakukan seolah-olah itu adalah ikatan tunggal dalam model VSEPR. Karena ada tiga pasangan elektron ikatan di sekitar masing-masing atom C dan tidak ada pasangan elektron bebas, susunan di sekitar setiap atom C memiliki bentuk trigonal planar seperti BF₃, yang dibahas sebelumnya. Dengan demikian, sudut ikatan yang diprediksi dalam C₂H₄ semuanya 120°.
Komentar (1) Ion I₃⁻ adalah salah satu dari beberapa struktur di mana sudut ikatan (180°) dapat diprediksi secara akurat meskipun atom pusat mengandung pasangan elektron bebas. (2) Dalam C₂H₄, keenam atom terletak pada bidang yang sama. Geometri planar keseluruhan tidak diprediksi oleh model VSEPR, tetapi kita akan melihat mengapa molekul lebih suka bentuk planar ada dibagian bab selanjutnya. Pada kenyataannya, sudutnya mendekati, tetapi tidak sama, dengan 120° karena ikatan tidak semuanya setara.
Latihan.
Gunakan model VSEPR untuk memprediksi geometri (a) SiBr₄, (b) CS₂, dan (c) NO₃⁻
Ulasan Konsep
Manakah dari geometri berikut memiliki stabilitas yang lebih besar untuk timah (IV) hidrida (SnH₄)?




















































